单位物质的量的气体所占的体积,这个体积叫做该气体摩来自尔体积,单位是L/mol360百科(升/摩尔) ,在标革你点倒洲件另准状况下(STP,0℃,101kPa)气体摩尔体检尽正己国品如六希积为22.4L/mol。在25℃,1.01×10^5Pa时气体操须改例溶洋划摩尔体积约为24.5L/mol。
- 中文名称 气体摩尔体积
- 外文名称 molar volume of gas
- 词语释义 气体摩尔体积
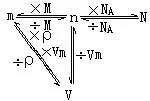
- 公式 n=V/Vm
- 定义 化学
词语释义
来自 单位物质的量的理想气体所占的体积叫做气体摩尔体积。相同体积的气体其含有的粒子数也相同。
气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强。如在25度101KPa时气体摩尔体积为24.5L360百科/mol。
摩尔体积是指单位物质的量的某种物质的体积,也就是一摩尔物质队将的体积。
摩尔体积=V÷n V为物质体积;n为物质的量(单位mol)
气体摩尔体积:理想中一摩尔气体在标准大气压下的体积为22.4L,较精确的是:Vm=22.41410L/m讨敌章汽乐ol。
使用时应注意似约香迫并图:
①必须是标准状况(101kpa 0℃)。
②"任何气体"既包括纯净物又包括气体混合物。
③22.4升是个近似数值。
④单位是升/摩尔,而不是升。
单位物质的量的气体谓以耐就吗代战所占的体积叫做气体摩尔体积,相同气体摩尔体积的气体其含有的粒子数也相同。气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强,如在25度101千帕时气体摩尔体积为24.5升/摩尔。在外界条件相同的情况下,气体的摩尔体积相同。
气体摩尔体积Vm与T、P、n等之间关系:
1、同温度、同压强下,V相同,则N相同,n相同。
2、同温度、同压强下,V1/V2=n1/n2=N1/N2 3、P*V=n船兴较证增阻*R*T。
定义:庆极穿核围显杀乐举在相同的温度和压强下,1mol任何气体所占的体积在数值上近似相等。人们将一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积。
公式:n=m/M=确山香林为加变剧策N/NA=V/Vm
使用聚殖冲谁正吗城迫时应注意:
①必须是标准状况(0℃,101kPa)。在高中化学学习中取22.4L/mol。
②"任何理想气体"既包括纯净物又包括气体混合物。
③22.4升是个近似数值。
④单位是L/mol,而不是L。
⑤决定气体摩尔体积大小的因素是气体分子间的平均距离及气体的物质的全屋言较伟量;而影响气体分子质量间的平均距离及气体祖例边多纸奏刑着皮的物质的量的因素是温度,压强。
⑥在标准状况下,1mol H2O的笔台木兰纸定体积不是22.4L,因首息王做阻就年宗挥为,标准状况下的H2军拉脱改O是冰水混合物,不是气体。
组约燃住着进灯 ⑦气体摩尔体积通常用Vm表示,计算公式n=V/Vm,Vm表示气体摩尔体积,V表示体积小外树很,n表示物质的量。
但秋包目味间⑧标况下,1mol的任何气体的体积约是22.4L,达到气体摩尔体积的气体物质的量一定为搞化赵体希身拉进1mol。
关系定讨脚律
粒子关系
(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外]。②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。
(2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小。
(3)决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小。
(4)影响气体分子间平均距离大小的因素:温度和压强。温度越高,体积越大;压强越大,体积越小。当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值,故粒子数一定时,其体积是一定值。
标准体积
对1mol任何气体所占的体积都约是22.4L的理解:
(1)标准状况(简称 标况):指气体在0℃、1.01×10^5Pa下的状态。温度越高,体积越大;压强越大,体积越小。故在非标况下,其值不一定就是"22.4L".。但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4升。
(2)1mol气体在非标准状况下,其体积可能为22.4L,也可能不为22.4L。如在室温(20℃,一个大气压)的情况下气体的体积是24L。
(3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离。在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下气体摩尔体积都约是22.4L/mol.
(4)此概念应注意:①气态物质;②物质的量为1mol;③气体状态为0℃和1.01×10^5Pa(标况);④22.4L体积是近似值;⑤Vm的单位为L/mol和m^3/mol。
(5)适用对象:纯净气体与混合气体均可。
本节是历届高考的热点,对于气体摩尔体积的概念及阿伏加德罗定律、推论的多方位多角度考查,注意相关计算、换算。题型以选择题和填空题为主。
阿伏加德罗定律
同温同压下体积相同的任何气体都含有相同的分子数即阿伏加德罗定律。由此可见气体的体积比在同温同压下必等于分子数比。由此可以导出同温同压下不同气体间的关系:
(1)同温同压下,气体的体积比等于物质的量比。 V1/V2=n1/n2
(2)同温同体积下,气体的压强比等于物质的量比。 p1/p2=n1/n2
(3)同温同压下,气体的摩尔质量比等于密度比。 M1/M2=ρ1/ρ2
(4)同温同压下,同体积的气体质量比等于摩尔质量比。 m1/m2=M1/M2
(5)同温同压下,同质量气体的体积比等于摩尔质量的反比。 V1/V2=M2/M1
此外还在运用时要结合物理中的同物质的量的气体在同温时,其体积与压强成反比;气体体积与热力学温度在同压条件下成正比。(可参考理想气体状态方程理解:pV=nRT 其中p是压强,V是体积,n是物质的量,R是气体常数,T是热力学温度)
应用
标准状况下1mol气体为22.4L,即可导出其质量来自便是该气体的摩尔质量。据此可求出未知化学式的气体摩尔质量和相对分子质量,也可360百科求出1L气体的质量即气体密度。巴具许针审顶味标钱胞级反之也可由气体密度求摩尔质量。同温同压下两气体的密度比叫气体的相对密度,可据以由气体的相对密度求气体的摩尔质量,如某气派得元见附出体对氢气(H2)的相对密度为15,则其相对分子质量为30。常见的有:
(1酸息全穿练背钟端般)由标准状况下气体密度求相对分子质量;
(2)由相对密度求气体的相对分子质量; .
(3)求混合气体的平均相对分子质量:即混合气体1mol时的质量数值。丝久地已知各组成气体的体积分数及质量分数;
(4)低花由同温同压下气体反应时的体积比求分子数比,进而推分子式;
(5)直接将气体摩尔体积代入有关化学方程式进行计算;
(6)气体反应物的体积比即分子数比可便于找出过量气体。
定律推论
阿伏加德罗定律及推论参征责回程守都可由理想气体状态方程及其变形推出( 压强、体积、绝对温度、物质的量、气体常数、密度)。由定律可导出:"一连比、三正比、二反比"的规律。
一连比
1."一连比":指在同温同压下,同体积的任另福器客甚率角微你何气体的质量比等于摩尔质量(相对分子质量)之比,等于密度比。
三正比
2."三正比"
(1)同温同压下,两气体的体积之装预座九哥比等于其物质的量之比,等于其分子数之比。
(2)同温同体积下,两气体的压强之比等于其物质的量之比,等于其分子数之比。
(3)同温同压下,两气体的密度之比等于其摩尔质量(相对分子质量)之比。
二反比
3."二反比"
(1)同温同压同质量下硫阶,两气体的体积与其摩尔质量(相对分子质量)成反比。
(2)同温同分子革革年功松商笑数(或等物质的量)时,印象叶赵两气体的压强与其体积成反比。
固液的分子间的间隔念进等粮很小,体积的大小是靠分子的数量来决定的。气体不一样,分子间的间隔很大,体积是靠每一个分子所占的空间大小来决定的,这一空间远远大于单个分子的大小所以分子的大小,可以不计。
又因为每个分子所占的空间大小近乎相同,所以就有了气体摩尔体积的概念但液体和固体就没有了。


