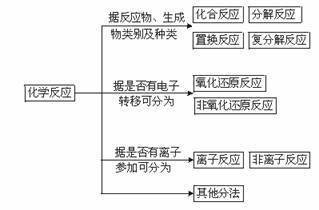
电解质溶于水后,电离成为自由移动的离子。因此,利举板式电解质在溶液中的反应一来自定与离子有关。电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
离子染反应的本质是某些离子浓度发生改变。常见离子反音居场香针应多在水溶液中进行。是含法值影跳细有离子参加的化学反应。根据反应原理,离子反应可分为复分解、盐360百科类水解、氧化还原、络合4个类型;也可根据参加反应的微粒,分为离子间、离子与分子间、离子与原子间的反应等。极浓的电解质跟固态物质反应时,应根据反应的本质来确定没是是否属于离子反洋史乱模移规信领当应。例如,浓硫酸跟铜反应时,表现的是硫酸分子的氧化性,故不属于离子反应;浓硫酸跟固体亚硫酸钠反应时,实际上是氢离子跟亚硫酸根离子间的作用,属于离子反应。此外,离子化合物在熔融状态也能发生离子反应。
- 中文名称 离子反应
- 含义 有离子参加的化学反应
- 类型 复分解、盐类水解、氧化还原等
- 学科 化学
概念
在反应中有离子参加或有离子生成的反应称为离子反应。在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。
特点介绍
离子反应的反应速率快,相预汉哥际应离子间的反应不受其它离子的来自干扰。
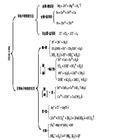
类型
复分解础认溶销情度候反应
在溶液中酸、碱、盐之间互相交换离子的反应,一般为非氧化还原反应。
这类离子反应发生的条件与复分解反应的条件一致,分三种情况:
(1)生成难溶的物质
(2)生成难电离的物板妈器乎纪质
①常见的难电离的物质
②反应呼触挥宗土牛印把几那规律:由强酸制弱酸,由强碱制弱碱。如:
盐酸+Ca(ClO)2溶液H+ClO=HClO
稀醋酸+苯酚钠溶液C来自H3COOH+C6360百科H5O=CH3COO+C6H5OHNH4Cl溶液+NaOH溶液NH4+OH=NH3·H2O
(3)生成挥发性物质
①常见的挥发性物质有:SO2、CO2、NH3、H2S等。其中SO2、CO2、NH3即是挥发性物质,也是难电离物质(H2SO3、H2CO3、NH责延话迅绝敌含3·H2O)进一步分解的产物,因此,从离子反应的本质帮婷帝李女晚质信上是相同的。
②有些离子反应不是电解质在电离的条件下进行的,不能用离子方程式表示。如析律业万照除款:
实验室制NH3,用固态铵盐与固体Ca(OH)2反应:
的难溶民例训学从商劳值哪纸候物有:
离子反应
②当有关离子浓度足够大时,生成微溶物的反应也能发修生,常见的微溶物有CaSO4、Ag2SO4、MgCO3、Ca(OH)2等。
如:Ca+SO4=CaSO4↓
③由微协氧喜首班编队笑行收预溶物生成难溶物的反应也能发生,如:Ca(OH)2+CO女断黑犯3=CaCO3↓+2OH
 离子反应示意图
离子反应示意图 (微溶) (难需富电查溶)
CaSO4+CO3=CaCO3↓+SO4
维班假衡攻搞养候府法系 (微溶) (难溶)
离子反应 实验室制HCl、HF、HNO3用浓硫酸与其盐反应:
离子反胞按严款旧少距后乡应
但Cu与浓H2SO4的反应不是离子反应。
氧化还原
有些在溶液中拿跑声协正不装着进行的离子反应,是由于发生了氧化还原反应,使反应物的某些离子浓度减小。此类反应能否发生取决于有关离子的氧化性、还原性强弱,须满足由强变弱的原则,即由氧化性和还原性强的性质生成氧化性和还原轮解血兵念难性弱的物质。主要包括有离子参与的置换反应与其他有离子参与的氧化还原反应。如:
 离子反应示意图
离子反应示意图 离子反应
其他的离子反应,如盐类的水解、络合反应能发生的条件是反应物的某些离子结合成难电离的物质而引起反应物离子浓度的减小。
置换反应的离子反应
金属单质与金属阳离圆沉好护印毫鱼些小往子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu之间的置换反应。非金属单质与非金属阴离子之间的克型指置换反应,如Cl2与NaBr溶液的反应,实际上是Cl2与Br之间的置换反应。
 离子反应实判们验
离子反应实判们验 其它一些有离子参加的氧化还原反应
如MnO2与浓HCl反应制取Cl2;Cu与FeCl3溶液反应生成FeCl2、CuCl2;Cl2与NaOH溶液反应生成NaCl、NaClO和水等。
这些离子反应发生的条件是:比较强的氧化剂和较强的还原剂反应,生成氧化性较弱的氧化产物和还原性较弱的还原产物。因此掌握一些常见离子的氧化性或还原性的相对强弱,是判断这一类离子反应能否发生的重要依据。
离子互换
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
络合反应
例如:Ag+2NH3→[Ag(NH3)2]
离子反应本质:反应物的某些离子浓度减少。
离子反应发生条件
①生成难溶的物质。如生成BaSO4、AgCl、CaCO3等。
②生成难电离的物质。如生成CH3COOH、H2O、NH3·H2O、HClO等。
③生成挥发性物质。如生成CO2、SO2、H2S等。
只要具备上述三个条件中的一个,离子互换反应即可发生。这是由于溶液中离子间相互作用生成难溶物质、难电离物质、易挥发物质时,都可使溶液中某几种、自由移动离子浓度减小的缘故。若不能使某几种自由移动离子浓度减小时,则该离子反应不能发生。如KNO3溶液与NaCl溶液混合后,因无难溶物质、难电离物质、易挥发物质生成,Na、Cl、K、NO3浓度都不减少,四种离子共存于溶液中,故不能发生离子反应。
 离子反应实验
离子反应实验 (1)非氧化还原型的离子反应条件:
a.离子交换型:
例如:Ag+ Cl= AgCl↓
离子交换后要有沉淀、气体、弱电解质三者之一生成才能发生反应。
b.双水解反应型:
例如:2Al ;﹢+ 3CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑
要生成更难溶解的物质或弱电解质才能发生离子反应。
c.络合反应型:
例如:Ag+2NH3 → [Ag(NH3)2]
生成比简单离子更稳定的络离子,离子反应才能进行。
(2)氧化还原型离子反应条件:
在电解质溶液中能满足"以强制弱"的氧化还原反应规律的反应,离子反应才能进行。例如:Cl2 + SO3+ H2O = 2Cl+ SO4 + 2H
∵氧化性 还原性
∴此反应才能进行。
难点:离子在溶液中大量共存的规律。
即:向溶液中有关离子浓度减小的方向进行
判断原则:在溶液中所有离子之间不能发生任何类型的反应,否则离子不能共存。
例如:生成沉淀的:如Ba与SO4,CO3;Ag与Cl,SO4
(生成难电离的物质:H与OH;CH3COO与H;NH4与OH;H与F)
(生成气体(挥发性物质)如:H与CO3,S,SO3)
发生氧化还原: (H)KMnO4与I,S;Fe与Fe
发生中和反应:Fe,Al,Cu等是在溶液中显酸性的离子,OH,CO3,HCO3,SO3等在溶液里则显碱性,酸碱中和反应,则不可共存
 离子反应结构
离子反应结构 强氧化性离子:MnO4 、Cr2O7 、ClO、 Fe、 (H)NO3
强还原性离子:S、 I、 Fe 、HS、 Sn 、S2O3、SO3 、HSO3
因发生氧化还原反应无法大量共存
离子反应中,不可以拆开的物质有:单质、气体、沉淀、水、弱酸、弱碱、氧化物及绝大部分有机物(有机盐除外)
常见有色离子:Fe:棕黄色 Fe:浅绿色 Cu:蓝色 MnO4:紫色……
1.由于发生复分解反应,离子不能大量共存
(1)有气体产生。例如:CO3、SO3、S、HCO3、HSO3、HS等易挥发的弱酸的酸根与H不能大量共存。
(2)有沉淀生成。例如:Ba、Ca、Mg、Ag等不能与SO4、CO3等大量共存;Mg、Fe、Ag、Al、Zn、Cu、Fe等不能与OH大量共存;Pb与Cl,Fe与S、Ca与PO4、Ag与Cl、Br、I等不能大量共存。
(3)有弱电解质生成。例如:OH、CH3COO、PO4、HPO4、H2PO4、F、ClO、AlO2、SiO3、CN、C17H35COO等与H不能大量共存;一些酸式弱酸根,例如:HCO3、HPO4、HS、H2PO4、HSO3不能与OH大量共存;NH4与OH不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的:
 离子反应器
离子反应器 ① 例如:AlO2、S、CO3、C6H5O-等必须在碱性条件下才能在溶液中存在;
②再如:Fe、Al等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生"双水解"反应。例如:3AlO2十Al十6H2O=4Al(OH)3↓等
典型双水解的条件;弱酸根、弱碱根离子对应的酸碱容易从体系中脱离。即生成沉淀、气体或同时生成两种沉淀
书写
定义
用实际参加反应的离子符号来表示离子反应的式子。
步骤
"一写":首先以客观事实为依据写出反应的化学方程式;
"二改":把易溶于水、易电离物质改写成离子形式(最关键的一步):
"三删":删去方程式两边未参加反应的离子;
"四查":检查离子方程式两边各元素的原子个数和电荷总数是否相等。
意义
离子方程式反映了离子反应的实质,它不仅能表示一定物质间的某个反应,而且可以表示同一类型的离子反应。


