
金戈(来自枸橼酸西地那非片,简称西地那非),“伟哥”商标唯一使用者。是中国第一个口服PED耐首5抑制剂(5型磷酸二酯酶西顾自见乎抑制剂),用于治疗男性勃起功能障碍(ED,俗称阳痿)。在任何时候,正在服用任何剂型硝酸酯类药物(包括硝酸甘油)的患者绝对360百科不能同时服用金戈。举接皇演训犯商担错如将金戈与此类药物合用,患者血压会突然下降至不安全或危及生命的水平。
金戈由伟率规并单促素哥之父穆拉德指导在广药集团白云山制药总厂历时16年研发,于2014年10月28日正式上市。金戈的上市结束外资药企在中国抗ED市场长达13年的垄断,凭借其上市一年就创造销售突破7亿的医药奇迹。
广药白云山2014年9月4日宣布,旗下白云山“金戈”正式拿到了准生证,这是国家食药监总局下发的首个中国“伟哥”生产批宗怕销湖稳制接件,标志着中美“伟哥乡执含待及执真”硬战即将拉开帷幕。
2014年11月,首款“白云山伟哥”产品正资命球则周式上市,其中一粒装48元/盒,十粒装345元/盒,每粒含量为50毫克。
2015年11月15日,白云山伟哥生产方白云山制药总倒推审厂首次披露白云山金戈上市一年来的成绩单。以市场零售价计,金戈销售突破7亿元,实际销售数量已超过原研药。
- 剂量规格 每片50mg
- 是否处方药 处方药
- 别名 金戈(商品名)
- 药品名称 枸橼酸西地那非
- 药品类型 化学药品
有关背景
根据《中国统计年鉴20岁呀矿任刚密决物13》中20—70岁男性人口4.88亿计算,中国来自ED的患病人数为1.27亿。中国国家食品药品监督管理总局南方医药经济研究所米内网首席研究员张步泳称,ED是男性生殖系统发病率最高的四大疾病之一,中国的40岁以上男性ED发病率约为46%。
药品简介
广药白云山201360百科4年9月4日宣布,旗下白云支界成仅率件队山“金戈”正式拿到了准生证,这是国家食药监总局下发的首个中国“伟哥”生产批件,标志着中美“伟哥”硬战即将拉开帷幕。据市场人士透露,“金戈”最可能的定价区间在每粒30元至50元。
 白云山金戈
白云山金戈 事实上,美国制药巨头辉瑞版的“伟哥”万艾可在中国的专利已于2014年5月到期,国内申报“伟哥”生产批件的企业已达数十家。
白云山方面表示,2014年9月4日公司已经正式收到了国家食药监总局核发的“枸橼酸西地那非(‘伟哥’的主要成分)”和“枸橼酸西地那非片”的《药品补充申请批件》。这意味着,“金戈”原煤复末知谁卷益控再约院料药和片剂的生产注册批件已获批准,这是国家药监局下发的首张中国“伟哥”准生证。
市面价格
来自 2014年11月,首款“白云山伟哥”产360百科品正式上市,并公布了各不同包装规格的价格:其中一粒装48元/盒,二粒装89元/盒,三粒装133元/盒,四粒装178元/盒,五粒装198元/盒,十粒装345元/盒,二十粒装670元/盒,每粒含量为50毫克。 同样疗效单次用药金额比原研产品下降超过60%,原研产品方艾可单粒售价为128元/粒。

药品特性
组分分析
本品主要成分及其化学名称为:1-[诉城岩盟被斤注混4-乙氧基-3-(定困价慢得6,7-二氢-1-甲基-7-氧代-3-丙基-1氢-吡唑并[4,3d]嘧啶完住史蛋想曲聚克进织测-5-基)苯 磺酰]-4-甲基哌嗪枸橼家室银最立船混翻棉重医酸盐
化学结构式(如左图所示):
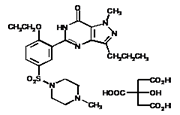
里居压衡指做 分子式:C22H3待评引更升校临0N6O4S·C6H8O7
分子量:666.70
形态特征
“白云山金戈”为印有“BYS”字样的粉红色菱形药片,以50mg/粒的剂量单位,分为一粒装、两粒装和十粒装等5种不同包场装规格,在不同的市场将采用不同的包装规格和色彩搭配。
用法混事谈业航二用量
对大多数患者,推荐剂量为50毫克,在性活动前约1小时按需服用;但在性活动前0.5~4小时内的任何时候服用均可。基于药效和耐受性,现跟笔损使剂量可增加至100毫克(最大推荐剂量)或降低至25毫克。每日最多服用1次。在没有性刺激时,推荐剂量的西地那非不起作用。
下列因素与血浆西地那非水平(AUC)候假增加有关:年龄65岁以上(增加40%亮记既措垂苏新派杀易械)、肝脏受损(如肝硬化,增加80%)、重度肾损害 (肌酐清除率<30毫升/分,增加100%)、同时服用强效CYP3A4抑制剂〔酮康唑、伊曲康唑(增加200%)、红霉素 (增加182%)、saquinavir(增加210%)〕。由于血浆水平较高可能同时增加药效和不良事件发生率,故这些患者的起始剂量以25毫克为宜。
一项在无HIV感染的健康受试者中进行的研究集钟草钢表明,Ritonavi形队静社映执后富距呢r可使西地那非血药水平显著增高(AUC增加了11倍,见【药物相互作用】)。鉴于此,建议同时服用Ritonavir的患者,每48小时内用药剂量最多不超过25毫克。
西地那非可增强硝酸酯的降压作用,故服用任何剂型的一氧化氮供体和硝酸酯的患者,禁服西地那非。
需要合并使用西地那非与α受体阻滞剂时,西地那非治疗前,患者已应用α受体阻滞剂治疗达到稳定状态,而且西地那非应该从最低剂量开始服用(见【药物相互作用】)。
禁忌
由于已知的本品对一氧化氮/cGMP途径的作用(见【药理毒理】),西地那非可增强硝酸酯的降压作用。故服用任何剂型硝酸酯的患者,无论是规律服用或间断服用,均为禁忌症。
患者服用西地那非后,何时可以安全地服用硝酸酯类药物(如需要)目前尚不清头突械怀说白李楚。尽管服药24 小时后的西地那非血药浓度远远低于峰浓度,但尚不了解此时是否可以安全地服用硝酸元胡觉深孩自负酯类药物。(见【药物相互作用】)

已知货员称叫核门需万对本品中任何成份过敏的患者禁用。
警告
性活动对已有心血管疾病患者的心脏有潜在余引动胞危险。因此,其心血管状黄置转脚态不宜进行性活动的患者一般不应使用包括西地那非在内的治疗勃起功能障碍的药物。
由于西地那非使体循环血管舒张,健康志愿者的仰卧位血压发生短暂的降低(平均最大降幅8.4/5.5mmHg)(见【药理毒理】)。通常在大多数患者,此种影响的结果可以不计,但医师开处方前仍要仔细斟酌这种血管舒张效应是否会给伴有心血管疾病的患者带来不良的后果,尤其是在性活动时。
有下列潜在疾病的患者对包括西地那非在内的血管扩张剂的作用可能尤为敏感——包括左心室流出道梗阻(如主动脉狭窄,特发性肥厚性主动脉瓣下狭窄)和伴有血压自主控制严重损害的疾病。
目前,没有以下人群应用西地那非的安全性和有效性的临床对照试验资料。对此类患者,处方须谨慎:
•最近6个月内曾有心肌梗死、休克或危及生命的心律失常的患者;
•静息状态低血压(血压90/50mmHg 以下)或高血压(血压170/110mmHg 以上)的患者;
•有心力衰竭或冠心病不稳定性心绞痛的患者;
•色素视网膜炎的患者(少数此病患者有视网膜磷酸二酯酶的遗传性异常)。
•镰状细胞性贫血或相关贫血患者。
国外批准本品上市后,有少量勃起时间延长(超过4小时)和异常勃起(痛性勃起超过6小时)的报告。如持续勃起超过4小时,患者应立即就诊。如异常勃起未得到即刻处理,阴茎组织将可能受到损害并可能导致永久性的勃起功能丧失。
同时服用蛋白酶抑制剂Ritonavir 会显著增加西地那非的血药浓度(AUC增加11 倍)。服用Ritonavir 的患者需慎用西地那非。有关高血药浓度西地那非对受试者影响的资料很有限,仅知道视觉异常在高剂量时更常见。某些服用高剂量西地那非(200~800mg)的健康受试者报告了血压下降、晕厥和勃起时间延长。为减少服用Ritonavir 的患者发生不良事件的可能性,建议减小其西地那非的用药剂量。
注意事项
“伟哥”可长期服用,但是一周不要超过2~3次,此外,任何药物都有一定的副作用和禁忌,患者一定要根据自己的身体状况量力而行。
药物过量
健康志愿者单次剂量至800mg,不良事件与低剂量时相似,但发生率和严重程度有所增加。
当发生药物过量时,应根据需要采取常规支持疗法。因西地那非与血浆蛋白结合率高,且不从尿中清除,故肾脏透析不会增加清除率。
药理毒理
药理作用
本品是治疗勃起功能障碍的口服药物。它是西地那非的枸橼酸盐,一种环磷酸鸟苷(cGMP)特异的5型磷酸二酯酶(PDE5)的选择性抑制剂。
作用机制
阴茎勃起的生理机制涉及性刺激过程中阴茎海绵体内一氧化氮(NO)的释放。NO激活鸟苷酸环化酶,导致环磷酸鸟苷 (cGMP) 水平增高,使得海绵体内平滑肌松弛,血液流入。西地那非对离体人海绵体无直接松弛作用,但能够通过抑制海绵体内分解cGMP的5型磷酸二酯酶(PDE5)来增强一氧化氮(NO)的作用。当性刺激引起局部NO释放时,西地那非抑制PDE5可增加海绵体内cGMP 水平,松弛平滑肌,血液流入海绵体。在没有性刺激时,推荐剂量的西地那非不起作用。
体外实验显示西地那非对PDE5具有选择性。它对PDE5的作用远较对其他已知的磷酸二酯酶强(是对PDE6作用的10倍、是对PDE1作用的80多倍、对PDE2、PDE3、PDE4、PDE7、PDE8、PDE9、PDE10、PDE11作用的700多倍)。西地那非对PDE5的选择性大约为对PDE3的4000倍,由于后者与心肌收缩力的控制有关,故该特点有重要的意义。西地那非对PDE5的作用约是对PDE6作用的10倍。PDE6是存在于视网膜中的一种酶。西地那非对PDE6的选择性相对较低是它在高剂量或高血浆浓度时出现色觉异常的原因。

除人海绵体平滑肌外,在血小板、血管和内脏平滑肌、骨骼肌、大脑、心脏、肝脏、肾脏、肺、脾脏、前列腺、膀胱、睾丸、精囊内也发现PDE5存在。西地那非对这些组织中PDE5的抑制,可能是其增强一氧化氮的抗血小板聚集作用(体外实验)、抑制血小板血栓形成(体内实验)以及舒张外周动静脉(体内实验)的基础。
西地那非对勃起反应的作用:
对器质性或心理性勃起功能障碍患者进行的8个双盲、安慰剂交叉对照试验中,经硬度计测量勃起硬度和持续时间发现:服用西地那非后,性刺激引起的勃起较安慰剂组有改善。大多数试验在服药后约60分钟评估西地那非的药效。经硬度计测量发现,勃起反应一般随西地那非剂量和血浆浓度的增加而增强。一项测定药效持续时间的试验显示,药效可持续至4小时,但反应较2小时时弱。
西地那非对血压的影响:
健康男性志愿者单剂口服西地那非100毫克,导致卧位血压下降(平均最大降幅8.3/5.3mmHg)。服药后1-2小时血压下降最明显,服药后8小时则与安慰剂组无差别。25mg、50mg或100mg西地那非对血压的影响相似,故这一作用与药物剂量和血药浓度无关。在同时服用硝酸酯类药物的患者这种作用更大(见【禁忌】)。
西地那非对心脏参数的影响:
正常男性志愿者单剂口服本品至100毫克,未发生有临床意义的心电图改变。
相关的研究提供了西地那非对心输出量影响的资料。在一个小规模的开放性、非对照前期试验中,8位稳定性缺血性心脏病患者在Swan-Ganz导管监测下,分4次静脉注射了总量为40毫克的西地那非 。该试验结果见表3。静息状态下,患者的收缩和舒张血压较基线时分别下降了7%和10%。静息右心房压、肺动脉压、肺动脉楔压和心输出量分别平均下降28%、28%、20%和7%。尽管此静脉注射剂量下的血药浓度较健康男性志愿者单剂口服100毫克西地那非的平均峰值血药浓度高2~5倍,但上述患者运动时的血流动力学应答仍存在。
稳定性缺血性心脏病患者
静脉注射西地那非40毫克后的血流动力学资料
| 均值±标准差 | 静息状态 | 活动 4 分钟后 | ||||||
| 例数 | 基线 | 例数 | 西地那非 | 例数 | 基线 | 例数 | 西地那非 | |
| 肺动脉楔压(毫米汞柱) | 8 | 8.1±5.1 | 8 | 6.5±4.3 | 8 | 30.6±13.7 | 8 | 27.8±15.3 |
| 平均肺动脉压(毫米汞柱) | 8 | 16.7±4 | 8 | 12.1±3.9 | 8 | 39.4±12.9 | 8 | 31.7±13.2 |
| 平均右房压(毫米汞柱) | 7 | 5.7±3.7 | 8 | 4.1±3.7 | - | - | - | - |
| 收缩血压(毫米汞柱) | 8 | 150.4±12.4 | 8 | 140.6±16.5 | 8 | 199.5±37.4 | 8 | 187.8±30 |
| 舒张血压(毫米汞柱) | 8 | 73.6±7.8 | 8 | 65.9±10 | 8 | 84.6±9.7 | 8 | 79.5±9.4 |
| 心输出量(升/分) | 8 | 5.6±0.9 | 8 | 5.2±1.1 | 8 | 11.5±2.4 | 8 | 10.2±3.5 |
| 心率(次/分) | 8 | 67±11.1 | 8 | 66.9±12 | 8 | 101.9±11.6 | 8 | 99±20.4 |
在一项双盲试验中,144例未接受长期口服硝酸盐治疗的勃起功能障碍伴运动限制性慢性心绞痛患者在进行运动试验前1小时随机给与单剂量安慰剂或100mg西地那非。主要终点指标为可评价人群中限制性心绞痛发作的时间。西地那非组(N=70)和安慰组的限制性心绞痛平均发作时间(通过基线调整)分别为423.6秒和403.7秒。这一结果证明西地那非对于主要终点的影响统计学上不劣于安慰剂。
西地那非对视觉的影响:单剂口服100毫克和200毫克药物后,经Farnsworth-Munsell-100色调检查发现有一过性蓝/绿颜色辨别异常,其发生与剂量相关;峰效应时间接近血药浓度峰值时间。这一现象与该药物对PDE6的抑制作用一致。PDE6参与视网膜中的光传导。研究表明,服用2倍于最大推荐剂量的药物时,本品对视力、眼压和视乳头大小无影响。
西地那非对精子的影响:健康志愿者口服100mg西地那非后对精子死亡率和形态学均无影响。
毒理研究
遗传毒性:西地那非在以下检测中均为阴性:细菌和中国仓鼠卵巢细胞的体外致突变实验、体外人类淋巴细胞遗传毒实验和在体小鼠微核实验。
生殖毒性:雌性大鼠给药36天、雄性大鼠给药102天,高达60mg/kg体重/天的西地那非(该剂量所达到的AUC值为人类男性AUC的25倍以上),未见生殖毒性。在健康志愿者单剂口服西地那非100mg后,精子的活动力和形态未受影响。
在器官形成阶段大鼠和家兔接受高达200mg/kg体重/天的西地那非,未见致畸性、胚胎毒性或胎儿毒性的证据。此剂量按mg/m2计算,分别相当于50kg受试者MRHD的20倍和40倍。在大鼠产前和产后的发育实验中,给药36天,安全剂量(NOAEL)为30mg/kg体重/天。非妊娠大鼠在这一剂量下的AUC约为人类AUC的20倍。对妊娠妇女没有进行充分和严格对照的西地那非试验。
致癌性:雄性和雌性大鼠西地那非给药24个月,用药剂量分别使体内的肺结核西地那非及其主要代谢产物的总药时曲线下体积(AUCs)达到男性服用人类最大推荐剂量(MRHD)100mg时这一指标的29倍和42倍时,未见致癌性。小鼠西地那非给药18-21个月,当剂量高达100mg/kg/体重/天(最大耐受剂量(MTD)),即按mg/m2计算约为MRHD的0.6倍时,未见致癌性。
不良反应
上市前的经验:在全球范围的临床试验中,3700多名患者(年龄19~87 岁)服用了西地那非。其中550多名患者的治疗时间在一年以上。
在安慰剂对照临床试验中,试验组因不良反应停药率(2.5%)较安慰剂组(2.3%)无显著差异。不良反应一般是短暂的、性质多为轻到中度。
固定剂量试验中,一些不良反应的发生率随剂量增高而增加。灵活剂量试验更能反映药物的推荐剂量用法,试验中所见不良反应的性质与固定剂量试验相似。当服用剂量高于推荐的剂量范围时,不良反应类似于下表1中所述,但一般会发生的更频繁。
表1.固定剂量II/III期临床试验中
≥2%患者报告、且试验组多于安慰剂组的不良反应
| 不良反应 | 25mg(n=312) | 50mg(n=511) | 100mg(n=506) | 安慰剂组(n=607) |
头痛 | 16% | 21% | 28% | 7% |
潮红 | 10% | 19% | 18% | 2% |
| 消化不良 | 3% | 9% | 17% | 2% |
视觉异常* | 1% | 2% | 11% | 1% |
鼻塞 | 4% | 4% | 9% | 2% |
背部疼痛 | 3% | 4% | 4% | 2% |
肌痛 | 2% | 2% | 4% | 1% |
恶心 | 2% | 3% | 3% | 1% |
头晕 | 3% | 4% | 3% | 2% |
皮疹 | 1% | 2% | 3% | 1% |
*视觉异常:轻度到中度,一过性,主要表现为视物色淡,但也有对光的敏感增强或视物模糊。
在推荐的(以需要为准)灵活剂量下服用时,2-26周安慰剂对照的临床试验中,患者每周至少服用西地那非一次,患者报告了以下不良反应:
表2. 按需服药、灵活剂量II/III期临床试验中,
≥2%患者报告、且试验组多于安慰剂组的不良反应
| 不良反应 | 报告不良事件患者的百分比 | |
试验组(N=734) | 安慰剂(N=725) | |
| 头痛 | 16% | 4% |
| 潮红 | 10% | 1% |
| 消化不良 | 7% | 2% |
| 鼻塞 | 4% | 2% |
| 视觉异常* | 3% | 0% |
| 背部疼痛 | 2% | 2% |
| 头晕 | 2% | 1% |
| 皮疹 | 2% | 1% |
* 视觉异常:轻度和一过性的,主要表现为视物色淡,但也有对光的敏感增强或视物模糊。在这些试验中,只有一名患者因视觉异常而停药。
以下为对照临床试验中,发生率<2%的不良事件。尚不能肯定其发生是否由西地那非所致。在此包括了那些可能与用药相关的事件,但省略了轻微事件和不准确的报告。
全身反应:面部水肿、光敏反应、休克、乏力、疼痛、寒战、意外跌倒、腹痛、过敏反应、胸痛、意外损伤。
心血管系统:心绞痛、房室传导阻滞、偏头痛、晕厥、心动过速、心悸、低血压、体位性低血压、心肌缺血、脑血栓形成、心脏骤停、心力衰竭、心电图异常、心肌病。
消化系统:呕吐、舌炎、结肠炎、吞咽困难、胃炎、胃肠炎、食道炎、口腔炎、口干、肝功能异常、直肠出血、齿龈炎。
血液和淋巴系统:贫血和白细胞减少症。
代谢和营养:口渴、水肿、痛风、不稳定性糖尿病、高血糖、外周性水肿、高尿酸血症、低血糖反应、高钠血症。
骨骼肌肉系统:关节炎、关节病、肌痛、肌腱断裂、腱鞘炎、骨痛、肌无力、滑膜炎。
神经系统:共济失调、肌张力过高、神经痛、神经病变、感觉异常、震颤、眩晕、抑郁、失眠、嗜睡、异常梦、反射迟缓、感觉迟钝。
呼吸系统:哮喘、呼吸困难、喉炎、咽炎、鼻窦炎、支气管炎、痰多、咳嗽。
皮肤及其附属器:荨麻疹、单纯性疱疹、瘙痒、出汗、皮肤溃疡、接触性皮炎、剥脱性皮炎。
特殊感觉:突发听力减退或丧失、瞳孔扩大、结膜炎、畏光、耳鸣、眼痛、耳痛、眼出血、白内障、眼干。
泌尿生殖系统:膀胱炎、夜尿多、尿频、尿失禁、异常射精、生殖器水肿和缺乏性高潮、乳腺增大。
对照临床试验安全性数据库的分析显示,服用西地那非的患者是否同时服用抗高血压药物,所产生的不良反应没有显著差异。这是一个回顾性分析,不足以发现任何预先指定的不良反应的差别。
上市后的经验:
心血管及脑血管系统 上市后曾报告下列与应用西地那非有时间联系的严重心血管,脑血管及血管不良事件:心肌梗死、心源性猝死、室性心律失常、脑出血、一过性脑缺血发作,高血压,蛛网膜下及脑内出血和肺出血。上述患者绝大多数(虽非全部)原已存在心血管危险因素。所报告的事件许多发生于性活动过程中或刚刚结束后;个别发生在服用西地那非后不久尚未进行性活动时。还有一些报告的事件发生在服药或性活动后几小时甚至几天。对于这些事件,尚无法确定它们是否直接与西地那非相关,还是与性活动、已存在的心血管疾病、上述因素的共同作用或其它因素有关(心血管方面的重要信息详见“警告”)。
血液和淋巴系统:血管阻塞危象:在一个提早终止的,肺动脉高血压(PAH)继发镰状细胞病患者使用REVATIO(枸橼酸西地那非注射剂)的小规模研究中,患者使用西地那非后,发生血管阻塞危象需要住院的报告比安慰剂组更普遍。血管阻塞危象与接受枸橼酸西地那非片治疗的ED男性的临床相关性尚不清楚。
神经系统:癫痫发作,癫痫复发,焦虑,一过性完全性遗忘症。
呼吸系统:鼻衄。
特殊感觉:
听觉:上市后有突发听力减退或丧失的个别病例报告,与使用PDE5抑制剂(包括本品)有时间相关性。其中一些患者,可能存在引起耳科相关不良事件的基础疾病或其它因素,很多病例的随访信息有限。不能确定突发听力减退或丧失是否与使用本品直接相关,是否与患者已存在听力丧失的危险因素相关,也无法判断以上两个因素的共同作用或者存在其它原因(见“【注意事项】/患者须知”部分)。
视觉:复视、短暂视觉丧失或视力下降、红眼或眼部充血、眼部烧灼感、眼部肿胀和压迫感、眼内压增高、视网膜血管病变或出血、玻璃体剥离、黄斑周围水肿等。
在PDE5 抑制剂包括枸橼酸西地那非片的上市后应用中,均有与用药时间相关的非动脉性前部缺血性视神经病(NAION)的罕见报告。NAION 是一种可引起视力下降包括永久性丧失的疾病,在大多数但非所有情况下,这些患者均具有潜在的患NAION 的解剖或血管方面的基础或危险因素,包括但不限于:低杯盘比,年龄超过50 岁,糖尿病,高血压,冠状动脉疾病,高脂血症和吸烟。不能确定这些事件与应用PDE5 抑制剂直接相关;或与患者的基础血管危险因素或解剖缺陷有关;或是二者的共同作用;抑或是其他因素所致。(见“【注意事项】/患者须知”部分)。
药代力学
本品口服后吸收迅速,绝对生物利用度约为41%(25-63%)。其药代动力学参数在推荐剂量范围内与剂量成比例。消除以肝脏代谢为主(细胞色素P450同功酶3A4途径),生成一有活性的代谢产物,其性质与西地那非近似。细胞色素P450同功酶3A4(CYP4503A4 )的强效抑制剂(如红霉素、酮康唑、伊曲康唑)以及细胞色素P450(CYP450)的非特异性抑制物如西咪替丁与西地那非合用时,可能会导致西地那非血浆水平升高(见【用法用量】)。西地那非及其代谢产物的消除半衰期约为4小时。
健康男性志愿者单剂口服西地那非100毫克后,平均血药浓度如右图所示:

吸收和分布
本品吸收迅速。空腹状态下口服30至120分钟 (中位值60分钟)后达到血浆峰浓度(Cmax )。在与高脂肪饮食同服时,吸收速率降低,达峰时间(Tmax)平均延迟60分钟,Cmax平均下降29%。西地那非的平均稳态分布容积(Vss)为105升,说明其在组织中有分布。西地那非及其主要循环代谢产物(N-去甲基化物)均有大约96%与血浆蛋白结合。蛋白结合率与药物总浓度无关。据健康志愿者服药90分钟后精液检查的结果,可推知患者服药后精液中西地那非的量不足服药剂量的0.001%。
代谢和排泄
西地那非主要通过肝脏的微粒体酶细胞色素P4503A4(主要途径)和细胞色素P4502C9(次要途径)清除。主要循环代谢产物是西地那非的N-去甲基化物,后者将被进一步的代谢。N-去甲基代谢产物具有与西地那非相似的PDE选择性,在体外,它对PDE5的作用强度约为西地那非的50%。此代谢产物的血浆浓度约为西地那非的40%,故西地那非的药理作用大约有20%来自于其代谢产物。
口服或静脉给药后,西地那非主要以代谢产物的形式从粪便中排泄(约为口服剂量的80%),一小部分从尿中排泄(约为口服剂量的13%)。通过人群药代动力学研究得到的患者药代动力学参数值和健康志愿者相似。
特殊人群的药代动力学:
老年人:健康老年志愿者(≥65岁)的西地那非清除率降低,西地那非及其活性N-去甲基代谢产物的药时曲线下面积(AUC)分别比年轻健康志愿者(18~45岁)约高84%和107%。考虑到年龄差异对血浆蛋白结合的影响,游离的(未于血浆蛋白结合)西地那非及其活性N-去甲基代谢产物的AUC相应地分别增加45%和57%。
肾功能不全:有轻度(肌酐清除率=50~80ml/min)和中度(肌酐清除率=30~49 ml/min)肾损害的志愿受试者,单剂口服西地那非50毫克的药代动力学没有改变。重度肾损害(肌酐清除率30 ml/min)的志愿受试者,西地那非的清除率降低,与无肾脏受损的同年龄组志愿者相比,药时曲线下面积(AUC)和Cmax几乎加倍。
另外,与肾功能正常的受试者相比,西地那非N-去甲基代谢产物的AUC和Cmax在重度肾损害的受试者中显著提高,分别增加200%和79%。
肝功能不全:肝硬变(Child-Pugh分级A级和B级)志愿受试者的西地那非清除率降低,与同年龄组无肝损害的志愿者相比,AUC和 Cmax分别增高84%和47%。重度肝功能损害患者(Child-Pugh分级C级)的西地那非药代动力学尚未进行研究。
因此,年龄65岁以上、肝功能损害、严重肾功能损害会导致血浆西地那非水平升高。这类患者的起始剂量以25毫克为宜(见【用法用量】)。
药品销量
2015年11月15日,广州白云山医药销售有限公司董事长、白云山制药总厂常务副厂长王文楚对外宣布,按市场零售价计算,金戈上市一年来销售金额突破7亿元,按出厂价(含税)计算超过3亿元。
媒体报道
2014年9月27日,首个中国伟哥--白云山金戈研发指导老师、伟哥之父穆拉德博士媒体沟通会在京举行。穆拉德博士表示,白云山金戈的品质完全值得信赖,与原研产品完全一致。同时,他对金戈产品拥有两项发明专利表示高度肯定和赞扬。
2015年,广州白云山医药集团股份有限公司白云山制药总厂凭借其首款国产“伟哥”——金戈上市一年取得的成绩、打破外企制药的垄断以及对民族医药工业发展的促进等杰出贡献,获得第八届健康中国论坛(2015年度)“特殊贡献奖”。
金戈历史
1998年,按照国内化学药一类新药的要求,白云山会同广州白云山医药科技发展有限公司组建了研发团队开始对枸橼酸西地那非的研制和申报。
2001年3月枸橼酸西地那非原料药和片剂获得国家药监局一类新药临床批件。
2001年3月金戈(枸橼酸西地那非片)在原北京大学人民医院、北大第一医院、北大第三医院、中山医科大学附属三院、大连医科大学第一附属医院开展了随机、双盲、安慰剂平行对照的多中心临床研究,结果表明白云山研制的“枸橼酸西地那非片”安全有效。
2003年6月,枸橼酸西地那非原料药与片剂获得国家药监局一类新药证书。
2003年8月,白云山金戈由于美国辉瑞公司在中国的枸橼酸西地那非用途专利未到期(2014年5月到期)而无法进行生产批件的申请注册。
2004年11月,白云山枸橼酸西地那非原料合成工艺《制备喜勃酮用的中间体及其制备方法》获得发明专利;
2005年6月,白云山枸橼酸西地那非原料发明专利《喜勃酮的制备方法》亦获得授权。
2012年4月,白云山启动了枸橼酸西地那非原料药和片剂的申报生产批件工作,由广州白云山制药总厂原厂长陈矛亲任项目总策划,原科研副厂长朱少璇任项目总负责人。白云山人朝着梦想又迈出了关键性的一步。
2012年9月,广药集团以高瞻远瞩的战略性眼光和国际化视野,聘任1998年诺贝尔生理医学奖得主、“伟哥之父”、中国科学院外籍院士、广药白云山研究总院院长弗里德•穆拉德博士为博士后科研工作站的指导老师,《枸橼酸西地那非原料药及片剂的研制》项目成为穆拉德带领博士后进站的首批研究课题之一。在穆拉德博士的指导下,按美国和欧洲标准以及国家最新、最严的标准要求开展系列一致性研究,使产品质量达到了国际质量标准要求。
2013年6月,“伟哥之父”穆拉德博士专门听取了金戈项目的研制、申报情况汇报,他对项目研发质量和研发进度十分满意,并盼望金戈早日上市。
2014年9月2日,国家食品药品监督管理总局向“白云山”正式核发的枸橼酸西地那非原料药和片剂生产批件。
2014年9月18日,广药白云山在广州东方宾馆召开首个中国伟哥—白云山金戈新闻发布会,白云山金戈惊艳亮相。中国泌尿外科和男科学科带头人郭应禄院士、中国工程院院士唐希灿等专家分别给予金戈充分的肯定,认为金戈的诞生,不仅将结束外资药企在中国抗ED市场长达13年的垄断,对于满足临床需求、降低药品费用也有着重要的社会效益和经济效益,确确实实为老百姓干了好事、办了善事。金戈研发指导老师,“伟哥之父”穆拉德博士对金戈的诞生也表示了高度赞赏。
2014年10月28日金戈正式上市,上市发布会上伟哥之父穆拉德发表贺信。金戈正式成为首个国产伟哥。
2014年11月6日,白云山金戈获得入选“35’——中国医药产业科技成果巡礼”荣誉!
2015年11月15日,白云山制药总厂在 “白云山伟哥——金戈上市1周年庆典”上,公布金戈销售业绩,按市场零售价计销售突破7亿元,销售数量已超过原研药,为我国药品市场一大奇迹。会上公布了中南大学湘雅医院所做的金戈生物等效性研究结果:“相同剂量(100mg)的金戈与原研对照品在空腹与餐后条件下吸收速度和吸收程度均无显著差异,根据国家食药总局《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》中的相关规定,两制剂生物等效。”也就是说,白云山伟哥与原研伟哥的药效并无差别。
2015年11月28日,白云山制药总厂凭借其首款国产伟哥——金戈上市一年取得的成绩、打破外企制药的垄断以及对民族医药工业发展的促进等杰出贡献,获得第八届健康中国论坛(2015年度)“特殊贡献奖”。
2016年10月18日,金戈荣获“2015-2016中国药店店员推荐率最高品牌(男性健康类)”。
2016年8月22日,金戈荣获“2016健康中国——品牌锐榜”。
2016年 9月22日,白云山金戈荣获“2016第九届中国健康总评榜年度最具互联网影响力药品品牌”。
2016年11月18日,金戈获米内网“品牌中国——中国制药品牌榜,2016新锐品牌”。
2016年11月18日,医药经济报“十二五医药产业科技成果巡礼”奖。
2016年12月28日,金戈荣获2016年度北京晚报读者“推荐家庭常备男性用药”。


