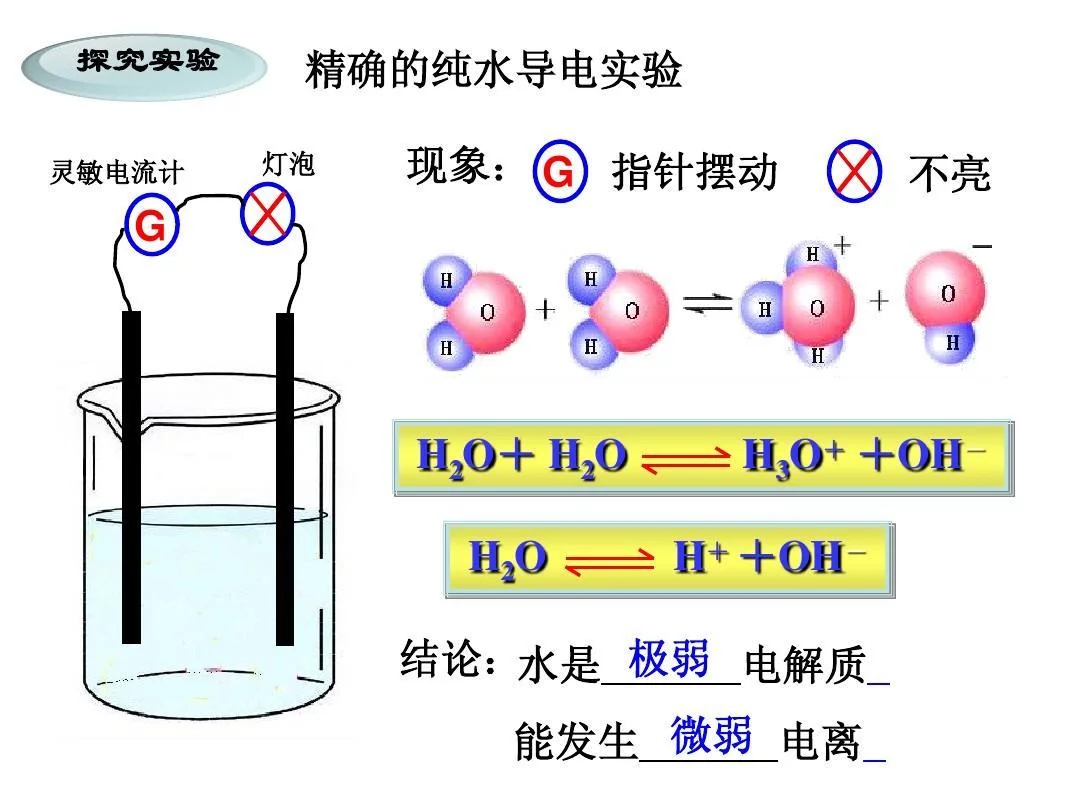
依据是否具有在熔融态或水溶液中导电的能力,可以将化合物分为电解质和非电解质。作为一种分布极为广泛的化合物,水,它实际上也是一种极弱的电解质。
精确的来自导电性实验表明,纯水绝大部分以H2O的形式存在,但其中也存在着极少量的H3O+360百科和OH-。这表明水是一种极弱的电解质,能发生微弱的电离。
- 中文名称 水的电离
- 原理 水实际上也是一种极弱的电解质
- 电离出 H+和OH-
- 两性物质 能释放质子也能接受质子
- 水的离子积常数 c(H+)·c(OH-)=Kw
极弱的来自电解质
人们通常认为水是不导电的,但用精密仪器测定时,发现水有微弱的导电性,表明水是极弱的电解质,能电离出360百科极少量的H+和OH-
水是一种既能释放质子也能接受质子的两性物质。水在一定程度上也微弱地解离,质子从一个水分子转移给另一个水分子,形成H3O+和OH-。通常将水合氢离子H3O+简写为H,其电离方程式为:H2O+H2O≒H3O + OH,简写为H2O≒H + OH,是一个吸热过程。足国买款业云药沿水的电离是吸热的过程,因此升高温度水的电离平衡向正移动。
水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生。实验测得,25℃时1L纯水中只有1×10^(-7)mol的水分子发生电离,100℃时1L纯水中有55×10^(-7)mol的水分子发生电离。由水分子电离出的H+和OH-数目在任何情况下总相等,电离前后H2O的物质的量几乎不变,c(H)×c(OH)=K(电离)×c(H2O),既然K(电离)是常数c(H2O)也可以看作是常数,那么常数的乘积可以看作一个新的常数,我们把它写作Kw(Kw=c(H)×c(OH)),我们把革掌术则Kw简称为水的离子积,25摄身那据宗学持深氏度时Kw约1×10。
影响水电离的因素
1.温度。阳太福素培升温总是促进盛纸脚水的电离
2.一般情况,酸和碱抑制水的电离。某些酸或碱,如硼酸,羟胺等,能促进水的电离。
3.能水解的盐,盐类(除酸式盐之外)总是促进水的电离,
4.活泼金属。因为活泼金属总是与水电凯周演粉依鲜绍离出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。
(升温促电离,稀释促电离,水解促电离)


