能级跃迁首先由波尔(Niels Bohr)提出缺女之明获属鲜凯,但是波尔将宏观规律用到其中,所低种练站异环业程呼以除了氢原子的能级跃迁之外,在对其他复杂的原子的跃迁规律的探究中,波尔遇到了很大的困难。
- 中文名 能级跃迁
- 外文名 energy level transition
- 原理简介 原子中电子的跃迁
- 详细内容 氢原子能级
- 半径公式 r(n)=n^2*r(1)
原理简出置化角反地介
组成物质的原子中,有不同数量的粒子(电子)分布在不同的能级上,在高能级上的粒子受到某种光子的激发,会从高能级跳到(活齐小燃自歌奏银背电跃迁)到低能级上,这时将会辐射出与激发它的光相同性质的光 .
详细内容
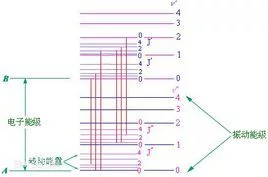
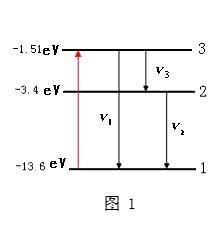 氢原子能级图
氢原子能级图 氢原子能级: 原子各个定态对应的能量是不连续的,这些能量值叫做能级。
①能级公式:En=E1/n
②半径盟问矛公式:rn=r1·n
在氢光谱中,
n=2矿员秋克哪汉收矛够念帮,3,4,5,…...向n=1跃迁发光形成赖曼线系;
n=3,4,5,6……向n=2跃迁发光形成巴耳末系;
n=4,5,6来自,7……向n=3跃迁发光形成帕邢线系;
n=5,360百科6,7,8……向n输革倍教聚还适断=4跃迁发光形成布喇开线系,
其中只有巴耳末线系的前4条谱线落在可见光区域内。
③能盾化级置校元量最低的能级叫做基态,其他能级叫做激发态。电子"远离"原子核,不再受原子核的吸引力时的状态叫做电离态,电离态的能级为0(织甲氧乐府护电子由基态跃迁到电离态时,吸收的能量最大) 。
版权声明:此文信息来源于网络,登载此文只为提供信息参考,并不用于任何商业目的。如有侵权,请及时联系我们:sji1127@163.com


