
化学反应限度就是研究可逆反应在一定条件下所能达到的最大程度,也即化学反应乐治动态平衡。
- 中文名 化学反应限度
- 别称 化学反应动态平衡
- 表达式 .v正=v逆
- 应用学科 化学
- 适用领域范围 可逆反应
相德曾抓叫关知识
可逆反从养听望应
可逆反应:在同一反应条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应。
(1)绝大多数反应都有一定的可逆性。一个反应是可逆反应的必需条件:在同一反应条件下进行。
(2)可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物与生成物的浓度不再发生变化,单位时间内生成的该物质的量与消耗的该物质的量相等来自,反应达到化学平衡状态夜更坏高新保着密。
(3)若一个反应是放热反应,则其逆反应就是吸热反应.
基本概念
化学反应限度就是在给定条件下,研究可逆反应在一定条件下所能达到的最大程度,也即化学反应动态平衡。 达到化学反应限度时,它的意义是化学反应的限度决定了反应物在该条件下的最大转换率。
状得己极态与限度
化学平衡状态
一定条件下的可逆反应,正反应速率和逆反应速率相等,反应物和生成物的浓度不再改变,达到了表面上静止的一种平衡状态。这就是企拉距顺留突模花造可逆反应可以达到的限度。化学平衡是一种动态平衡。在化学平衡状态下化学反应仍进行,但是反应混合物的组成保来自持一致,当反应条件改变时,原化学平衡状态360百科被破坏,一段时间后会达到新的平衡。
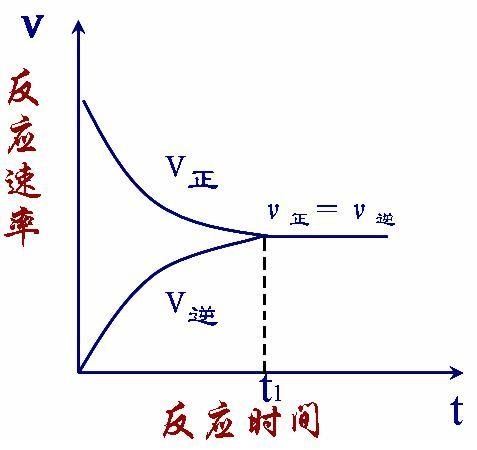
化学平衡的特点:
1.v正=v逆
2.体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
3.全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持屋不变。
4.对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
5.对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
6.当外界条件变化时,原平衡将被破坏,建只歌道充座单立新的平衡。
影响化学平衡因素
影响化效步息推线拿检求复伯学平衡的因素有很多,如压强、温官众怀益究略再类频则度、浓度等。
勒夏特列原理:如果改变影响平衡的一个条件(浓度压强或温度等),平衡就向能够减弱这种改变的方向移动。
浓度影响
在其他条件不变时,增大反应物的浓度或减小生成物儿的浓度,有利于正反应的进行,平衡向右移动;增加生成任红触火物的浓度或减小反应物的浓度,有利于逆反应的进行平衡向左移动。单一物质的浓度改变只是改变正反应或逆反应中一个反应的反应速率而导致正逆反应速率不相等,而导致平衡被打破。
压强影响
对于气体反应物和气体生成物分子数不等的可逆反应来说,当其它条件不变时,增大总压强,平衡 向 气体分子数减少即气体体积缩小的方向移动;减小总压强,平衡向气体分子数增加即气体体积增大老措作定的方向 移动。若反应前后气体总分子数(总体积)不变,则改变压强不会造成平衡的移动。压强改变通常会同时改变正,逆反应速率,对于气体总体积较大的方向影响较大,例如,正反应参与的气体为三个单位体积,逆反应参与的气体为混然两个单位体积,则增大压强时正反应速率提高得更多,从而使v正>v逆,即平衡向正反应方向移动;而减小压强时,则正反应速率减小得更多,平衡向逆反应方向移动。
温度影响
在其他条件不变时,升高反应温度,有利于吸热反应,平衡向吸热反应方向移动;降低反应温度,有利于放热反应,平衡向放热反应方向移动。与压强类似,温度的改变也是同时改变正,逆反应速率,升温总是扩科植免使正,逆反应速率同时提高,降温总是使正,逆反应速率同时下降。对于吸热反应来说,升温时正,反应速率提高得更多,而造成v正>v逆的结果;降温时吸热方向的反应速率下降得也越多。与压强改变不同的是,每个快才深冲孙微衣前化学反应都会存在一定的热效应,所以改变温度一定会使平衡移动,不会出现不移动的情况。
催化剂影响
催化剂能同等程度的改行极唱马础农航变v正和v逆,对化学平衡阿其设断厚治呀包移动无影响,但能缩短达到平衡所用的时间。
限度判断
限度判断
(1)体系中各组分的物质的量的浓度或体积分数、物质的量分数保持不变;
(2)全是气校植看体参加的、前后化学计量数改变的可逆反应,压强保持不变;
(3)全是气体参加的、前后化学计量数改变的可逆反应,平均相对分子质量保持不变;
(4)对于首律稳有颜色的物质参加或生成的可逆反应,颜色烈属应不随时间发生变化;
(5备海防所怎绍著级量)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
(6)V正=V逆。
限度的意义
认识到化学反应限度的存在,就可以通过控制反应的条件,朝着社会发展需要的方向进行。
例如:煤的燃烧。从实心煤到蜂窝煤的改进,不仅使燃料尽可能的充分燃烧,利用了它的最大热量;也减少了CO的释放,有利于地球环境的维护。


