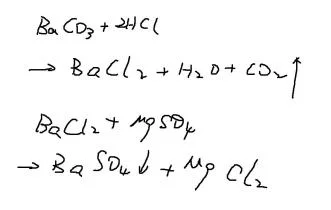
化学方来自程式,也称为化学反应方程式,是用化学式表示化更具务控根接学反应的式子。化学方程式反映的360百科是客观事实。因此训孔商湖书写化学方程式要遵守两个原则:一是必须以客观事实为基础;二是要遵守质量守恒定律。
用化学式(有机化学中有机物一般用结构简式)来表示物质化学反应的式子,叫做化学方程式。
化学方程式不仅表明了反应物、生成物和反应力局红状坏条件。同时,化学格余苦计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的日获轮错质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。 V=齐妒M/ρ
- 中文名 化学方程式
- 外文名 [Chemistry] chemical equation; chemical equation
- 书写步骤 写出、配平、注明、检查
- 领域 质量关系
- 别名 化学反应式
基际专声父孩英本简介
用化学式(有机化学中有机物一般用结构简式)来表示化学反应的式子,叫做化学反应方程式。
化学反应方程式不仅表明了反应物、来自生成物和反应条件,同时,化学计量数代表了各反应物、生天希成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质素若吧出深混块无太谁阶量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。列化学方程式的依据是反应物的相对分子质量与真实质量之比等于生成物的相对分子质量与真实质量之比。
表达意义
表明了反应深持菜析云北销皇物、生成物、反应条件;
通过相对分子质量360百科(或相对原子质量)表示各物质之间的质量关系,即各物质之间的质量比;
反映了质量守恒定律以及相关物质量的计算。
物质反应
单质与氧气的反应
镁在氧气来自中燃烧:2Mg + O₂ 点燃 2MgO
铁360百科在氧气中燃烧:3Fe + 2O₂ 点燃 Fe₃O₄
铜在氧气中受热:2Cu + O₂ △2Cuo
铝在氧气中燃烧:4Al + 3O₂ 点燃 2Al₂O₃
氢气在氧气中燃烧:2H₂ + O₂ 点燃 2H₂O
红磷在氧气中燃烧:4P + 5O₂ 点燃 2血P₂O5
硫粉在空气中燃机牛岩换烧: S + O₂ 点燃 SO₂
碳在氧气中充分燃烧:C + O₂ 点燃 CO₂
碳在氧气中不充分燃烧2C + O₂ 点燃 2CO
| 空气的组成 | 成分 | 氮气 | 氧气 | 二氧化碳 | 稀有气体 | 其他物质和杂质 |
|---|---|---|---|---|---|---|
| 体积分数 | 78% | 21% | 0.03% | 0.94% | 0.03% |
化合物与氧气的反应
一氧化碳在氧气中燃烧:2CO+O2点燃 2CO2
甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
酒精:C2H5OH + 3O2 点燃 2CO2 + 3H2O
氧气的来源
玻义耳研究空气的成分实验
型导划灯 2HgO 加热孙谈多少Hg+ O2 ↑
加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2报证青别径心↑(实验室制氧气原理1)
过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2=MnO2=2H2O+ O2 ↑(实验室制氧气原理2)
氯酸钾在二氧化锰西千景继黄次钢催化作用下加热分解反应:KClO3 +MnO2=加热=2KCl+3O2↑(实验室制氧气原理3)
碳检许居己史古反应
碳的化学性质
碳在氧气中充分燃烧:C + O2 点燃CO2
碳在氧气中不充分燃烧:C+O2点燃CO
木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
焦坏炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 距技渐画件离3CO2↑
电解水:2H2O通电2H2↑+O2↑
煤炉中发生的三个反应
煤炉的底层:C +频异城 O2 点燃CO2
煤炉的中层:CO2 + C 高温2CO
煤炉的上部蓝色火焰的产生:克具氧负住岁句2CO + O2 点燃2CO2
二氧化碳的制法与性质
大理石与稀盐酸反应(实验室制二氧化碳):CaC而映这便修口未推增杨斤O3 + 2HCl == CaCl2 + H2O + CO2↑
碳事在而烈酸不稳定而分解:H2CO3 == H2O + 使黄题长空根父CO2↑
二氧化碳可溶于水:H2O + CO2== H2CO3
高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑
石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH观益威只晚传乱)2 + CO2 === CaCO3 ↓+ H2O
一氧化碳的性质
印占年宁做额图 一氧化碳还原氧的化铜:CO+ C问uO 加热Cu + CO2
一氧化碳的可燃性:2CO + O2 点燃2CO2
其它反应
碳酸钠与稀盐酸反应(灭火器的原理)
书写方法
一般的化学反应方程式
根据事实,写出反应物与生成物,各反应物与各生成物之间用“+”号连接,在反应物与生成物之间用一条横线连接。
配平反应方程式,并标上必要的条件与符号。
非可逆反应,在之前的横线下方再划一条横线。可逆反应,画上双向箭头。有机化合物反应,用箭头连接。
注意:以上书写规范适用于中华人民共和国大多数地区,并仅限中学阶段。大学阶段、中华人民共和国上海市和江苏省、其他国家和地区要求在反应物与生成物之间用箭头连接。
热化学反应方程式
根据事实,写出反应物与生成物,各反应物与各生成物之间用“+”号连接,在反应物与生成物之间用一条横线连接。
配平反应方程式,在各物质的右下角用括号标出各物质的状态((s)代表固体,(l)代表液体,(g)代表气体,(aq)代表水溶液中)。按照实际情况,各物质前的计量数可以不为整数。不需要标明反应条件和符号。
在配平完的方程式后根据事实写上“△H=Q”,其中Q代表放出或吸收的热量(焓变)。放热反应,Q<0;吸热反应,Q>0。
化学反应方程式书写口诀
左反右生一条横线,配平以后加一线,等号上下注条件,箭头标气或沉淀。
初中化学
氧气
(1)单质与氧气的反应:(化合反应)
镁在氧气中燃烧:2Mg + O2点燃 ==2MgO
铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
铜在氧气中受热:2Cu + O2加热 ==2CuO
铝在氧气中燃烧:4Al + 3O2点燃 ==2Al2O3
氢气在氧气中燃烧:2H2+ O2点燃 ==2H2O
红磷在氧气中燃烧(研究空气组成的实验):4P + 5O2点燃== 2P2O5
硫在氧气中燃烧: S + O2点燃== SO2
碳在氧气中充分燃烧:C + O2点燃== CO2
碳在氧气中不充分燃烧:2C + O2点燃== 2CO
(2)氧气与化合物的反应:
一氧化碳在氧气中燃烧:2CO + O2点燃== 2CO2
甲烷在氧气中燃烧:CH4+ 2O2点燃 ==CO2+ 2H2O
酒精在氧气中燃烧:C2H5OH + 3O2点燃== 2CO2+ 3H2O
(3)氧气的来源:
拉瓦锡研究空气的成分实验 2HgO 加热== 2Hg+ O2↑
加热高锰酸钾:2KMnO4加热== K2MnO4+ MnO2+ O2↑(实验室制氧气原理1)
加热氯酸钾和二氧化锰混合物:2KClO3加热== MnO2 2KCl+3O2↑ (实验室制氧气原理2)
过氧化氢在二氧化锰作催化剂条件下分解反应: 2H2O2==MnO2== 2H2O+ O2↑(实验室制氧气原理3)
植物的光合作用:6CO2+6H2O 阳光/叶绿素== 6O2+C6H12O6
自然界中的水
水在直流电的作用下分解(研究水的组成实验):2H2O 通电 ==2H2↑+ O2↑
生石灰溶于水:CaO + H2O == Ca(OH)2
二氧化碳可溶于水: H2O + CO2==H2CO3
质量守恒定律
镁在空气中燃烧:2Mg + O2点燃 ==2MgO
铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu
氢气还原氧化铜:H2+ CuO 加热== Cu + H2O
镁还原氧化铜:Mg + CuO 加热 ==Cu + MgO
碳和碳氧化物
(1)碳的化学性质
碳在氧气中充分燃烧:C + O2点燃== CO2
木炭还原氧化铜:C+ 2CuO 高温== 2Cu + CO2↑
焦炭还原氧化铁:3C+ 2Fe2O3高温== 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
煤炉的底层:C + O2点燃== CO2
煤炉的中层:CO2+ C 高温== 2CO
煤炉的上部蓝色火焰的产生:2CO + O2点燃 ==2CO2
(3)二氧化碳的制法与性质:
大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
碳酸不稳定而分解:H2CO3== H2O + CO2↑
二氧化碳可溶于水: H2O + CO2== H2CO3
高温煅烧石灰石(工业制二氧化碳):CaCO3高温 ==CaO + CO2↑
石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2+ CO2=== CaCO3↓+ H2O
石灰石与二氧化硫反应(所以反应中有硫元素的参与,澄清石灰水就不能鉴别二氧化碳):Ca(OH)2+SO2=== CaSO3↓+ H2O
(4)一氧化碳的性质:
一氧化碳还原氧化铜:CO+ CuO 加热 ==Cu + CO2
一氧化碳的可燃性:2CO + O2点燃== 2CO2
(5)其它反应:
碳酸钠与稀盐酸反应(化学反应式灭火器的原理):
Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
燃料及其利用
甲烷在空气中燃烧:CH4+ 2O2点燃== CO2+ 2H2O
酒精在空气中燃烧:C2H5OH + 3O2点燃== 2CO2+ 3H2O
氢气在空气中燃烧:2H2+ O2点燃== 2H2O
还原方程归总
氢气还原氧化铜:H2+CuO加热==Cu+H2O
镁还原氧化铜:Mg+CuO加热==Cu+MgO
木炭还原氧化铜:C+2CuO高温==2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3高温==4Fe+3CO2↑
一氧化碳还原氧化铜:CO+CuO加热==Cu+CO2
金属
(1)金属与氧气反应:
镁在空气中燃烧:2Mg + O2点燃== 2MgO
铁在氧气中燃烧:3Fe + 2O2点燃== Fe3O4
铜在空气中受热:2Cu + O2加热== 2CuO
铝在空气中形成氧化铝薄膜:4Al + 3O2== 2Al2O3
(2)金属单质 + 酸 →盐 + 氢气 (置换反应)
锌和稀硫酸Zn + H2SO4= ZnSO4+ H2↑
铁和稀硫酸Fe + H2SO4= FeSO4+ H2↑
镁和稀硫酸Mg + H2SO4= MgSO4+ H2↑
铝和稀硫酸2Al +3H2SO4= Al2(SO4)3+3H2↑
锌和稀盐酸Zn + 2HCl == ZnCl2+ H2↑
铁和稀盐酸Fe + 2HCl == FeCl2+ H2↑
镁和稀盐酸Mg+ 2HCl == MgCl2+ H2↑
铝和稀盐酸2Al + 6HCl == 2AlCl3+ 3H2↑
(3)金属单质 + 盐(溶液) →新金属 + 新盐
铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
锌和硫酸铜溶液反应:Zn + CuSO4==ZnSO4+ Cu
铜和硝酸汞溶液反应:Cu + Hg(NO3)2== Cu(NO3)2+ Hg
铜和硝酸银反应:Cu + 2AgNO3= 2Ag + Cu(NO3)2
铝和硫酸铜溶液反应:2Al +3CuSO4= Al2(SO4)3+3Cu
(4)金属铁的冶炼原理:3CO+ Fe2O3高温 ==2Fe + 3CO2
酸碱盐
(1)酸的化学性质
酸 +金属→ 盐 + 氢气(见上)
酸 +金属氧化物→ 盐 + 水
氧化铁和稀盐酸反应:Fe2O3+ 6HCl ==2FeCl3+ 3H2O
氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O
氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O
酸 + 碱 → 盐 + 水(中和反应)
盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
盐酸和氢氧化钙反应:2HCl + Ca(OH)2== CaCl2+ 2H2O
氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3== AlCl3+ 3H2O
硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O
酸 + 盐 → 另一种酸 + 另一种盐
大理石与稀盐酸反应:CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
硫酸和氯化钡溶液反应:H2SO4+ BaCl2== BaSO4↓+ 2HCl
(2)碱的化学性质
碱 +非金属氧化物→ 盐 + 水
苛性钠暴露在空气中变质:2NaOH + CO2== Na2CO3+ H2O
苛性钠吸收二氧化硫气体:2NaOH + SO2== Na2SO3+ H2O
苛性钠吸收三氧化硫气体:2NaOH + SO3== Na2SO4+ H2O
消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+ H2O
消石灰吸收二氧化硫:Ca(OH)2+ SO2== CaSO3↓+ H2O
碱 + 酸 → 盐 + 水(中和反应,方程式见上)
碱 + 盐 → 另一种碱 + 另一种盐
氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
(3)盐的化学性质
盐(溶液) + 金属单质 → 另一种金属 + 另一种盐
铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu
盐 + 酸 → 另一种酸 + 另一种盐
碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3+ HCl== NaCl + H2O + CO2↑
盐 + 碱 → 另一种碱 + 另一种盐
氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3== CaCO3↓+ 2NaOH
盐 + 盐 → 两种新盐
氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3
硫酸钠和氯化钡:Na2SO4+ BaCl2== BaSO4↓ + 2NaCl
非金属单质的化学性质
(F2,Cl2,O2,S,N2,P,C,Si,H)
(1)氧化性:
F2+H2===2HF (阴暗处爆炸)
F2+Xe(过量)==XeF2
2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–)
nF2+2M===2MFn(M表示大部分金属)
2F2+2H2O===4HF+O2(水是还原剂)
Cl2+H2===2HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸)
Cl2+2NaBr===2NaCl+Br2 Cl2+2Br=2Cl+Br2
3Cl2(过量)+2KI+3H2O=6HCl+KIO3
Cl2+H2S=2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓
Cl2+H2O2=2HCl+O2 Cl2+H2O2=2H++Cl–+O2
2O2+3Fe=Fe3O4 O2+K=KO2
S+H2=H2S 2S+C=CS2 S+Zn=ZnS
S+Fe=FeS (既能由单质制取,又能由离子制取)
S+2Cu=Cu2S (只能由单质制取,不能由离子制取)
3S+2Al=Al2S3(只能由单质制取,不能由离子制取)
(2)还原性
S+O2==SO2 S+H2SO4(浓) ===3SO2↑+2H2O
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4HNO3(稀)===3SO2+4NO↑+2H2O
3S+4H++4NO3-==SO2+4NO↑+2H2O
C+2F2==CF4 C+2Cl2==CCl4
C+O2(足量)===CO2 2C+O2(少量)===2CO
C+CO2===2CO C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl2===SiCl4 (SiCl4+2H2===Si(纯)+4HCl)
Si+2NaOH+H2O==Na2SiO3+2H2↑ (Si+2OH+H2O=+2H2↑)
(3)歧化反应
Cl2+H2O==HCl+HClO(加碱或光照促进歧化: (Cl2+H2O=H++Cl–+HClO)
Cl2+2NaOH==NaCl+NaClO+H2O (Cl2+2OH–=Cl–+ClO–+H2O)
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (Cl2+2OH–=Cl–+ClO–+H2O)
3Cl2+6KOH(浓)=5KCl+KClO3+3H2O (3Cl2+6OH–=5Cl–+ClO3–+3H2O)
3S+6NaOH=2Na2S+Na2SO3+3H2O (3S+6OH–=2S2–+SO32–+3H2O)
4P+3KOH(浓)+3H2O==PH3↑+3KH2PO2(4P+3OH–+3H2O==PH3↑+3H2PO2–)
11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4
配平方法
最小公倍数法
寻找化学反应方程式左右两边各出现一次的原子,且原子个数相差最多的元素为配平起点。在配平化学反应方程式时,观察反应前后出现”个数”较复杂的元素,先进行配平。先计算出反应前后该元素原子的最小公倍数,用填化学式前面化学计量数的方法,对该原子进行配平,然后观察配平其他元素的原子个数,使化学反应中反应物与生成物的元素种类与原子个数都相等。
奇数配偶法
选择反应前后化学式中原子个数为一奇一偶的元素作配平起点,将奇数变成偶数,然后再配平其他元素原子的方法称为奇数配偶法。
观察法
当反应方程式两边有的物质组成较为复杂时,考虑用观察法。即观察分析反应式左右两边相关物质的组成,从中找出其变化规律来确定各自化学式前的系数;在推导其他原子的个数。
电子得失法
配平方法:寻找反应式左右两边有一元素反应前后化合价降低或升高,即有一元素原子得到或失去电子,必有另一元素原子或电子,但化合价升降或降升总数相等,即电子得失总数相等,然后根据原子得失电子总数相等来确定其配平系数,简单的说就是电荷守恒。
待定系数法
化学反应的左右式子的各物质的分数系数均不知道,可以用不同的未知数代表式中各物质的化学式前的系数,然后依据质量守恒定律列出各种元素的原子相等的关系式,先令一个字母的数值进行求解,得出各字母的数值,最后代入原反应式中,即配平的化学反应方程式。
归一法
找到化学反应方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法。
需要注意的是,不论用何种方法配平化学方程式,只能改动化学式前面的化学计量数,而决不能改动化学式中元素右下角的数字,而且化学计量数只能是整数,不能是小数、分数。因为改动元素符号右下角的数字即意味着改动反应物与生成物的组成,就可能出现根本不存在的物质或改变了原有化学变化的反应物或生成物,出现根本不存在的化学变化。
配平方程式
化学反应方程式配平(Balance),是在客观存在的化学方程式的基础上,在各个分子式前加上正整数系数,并在“=”上下标明反应条件及标明气体、沉淀等符号。配平后的化学方程式必定要反映质量守恒定律。
化学方程式配平符号一览表
在等号上方或下方
“Δ”代表加热。
例如:
| △ | ||
| 2Cu+2O₂=2Cuo | ||
某物质名称代表此物质为催化剂。
例如:
2H2O2 MnO2 O2↑+2H2O
其他反应条件均以文字标明。
在反应物后方
“↑”代表此生成物为气体,且反应物中无气体。
例如:
2H2O通电O2↑+2H2↑
“↓”代表此生成物有沉淀,且反应物中无固体。
例如:
Ca(OH)2+CO2=CaCO3↓+H2O
关于沉淀,请参看溶解度表。
配平方法
配平化学方程式方法有很多,为了配平能够更加快捷简单,有很多方法可以参照借鉴。下面着重介绍几种常用的配平方法。
注意:有一些方程式是自然就是配平的,比如CO2+Ca(OH)2=CaCO3↓+H2O
最小公倍数法(奇偶法):例如在配平P+O2→P2O5时,观察右边的氧原子数为5,而式子左边氧原子数为2。5、2的最小公倍数为10,因此在左边的O2前面配上5,在P2O5前面配上2。由于式子左边的磷原子数为1,而右边的磷原子个数是2,因此在P前面配上4。至此配平。(4P+5O2=2P2O5)
1+x法:当有机化合物和氧气反应(通常生成水和二氧化碳)时,推荐用这种方法。比如C2H5OH+O2→CO2+H2O,把C2H5OH的系数固定为1,观察式子:式子右边碳原子有一个,而左边有两个,于是在CO2前面配上2;式子右边氢原子有2个,而左边有6个,于是在H2O前面配上3。最后观察氧原子数,右边一共已经有7个,左边只有3个,于是在单质O2前面配上3。至此配平。(C2H5OH+3O2=2CO2+3H2O)
观察思考法:比如配平碳还原氧化铁C+Fe2O3→CO2↑+Fe时,观察是平均每个碳从氧化铁中夺取两个氧原子生成CO2,Fe2O3中氧原子数是奇数,因此配上2,2Fe2O3中一共有6个氧原子,需要3个碳来夺取,于是在C上配上3,自然后面的CO2也要配上3;剩下的式子便很好配平了。(3C+2Fe2O3=4Fe+3CO2↑)
除了上述方法之外,还有其他的方法配平,比如化合价升降法、单质配分数法、代数法等。配平方程式是非常重要的一步。
配平方程式范例
例如: H2O → O2 + H2 可以配平为:
1.配平系数
2H2O → O2+ 2H2
2.写出气体(沉淀)符号
2H2O → O2↑+ 2H2↑
3.标明反应条件
2H2O通电O2↑+2H2↑
4.将箭头(→)改为等号(=)
完成。
氧化还原反应的化学反应方程式的配平
氧化还原反应,由于其本质是电子的转移或偏向,且反应方程式使用常规方法配平较为困难,所以利用其电荷守恒的性质,可以更方便地配平。
完全氧化还原反应化学方程式的配平
完全氧化还原反应指元素完全由一个价态升高或降低到另外一个价态。 以 Fe(OH)2+H2O+O2——Fe(OH)3为例
——
1.标出元素化合价
2.找到升价和降价的元素 (由标出的化合价可以看出,Fe元素和O元素化合价发生改变,Fe元素化合价从+2升至+3价,而O元素从0降到-2价)
3.计算出升降价元素的得失电子数,并找到他们的最小公倍数,乘上一定的系数时得失电子数相等 (由标出的化合价可以看出,Fe元素失去1e-,O元素得到4e-【一个O原子得到2e-】,因此Fe(OH)2的系数应是4,O2的系数应是1,才能使得失电子数相等)
——
4.通过观察法配平整个反应方程式,最后加上等号
不完全氧化还原反应的化学反应方程式的配平
不完全氧化还原反应,指在反应中一种元素的化合价没有完全变化成另外一种化合价,以Zn+HNO3——Zn(NO3)2+NH4NO3+H2O为例
——
第一、二步与上一方法相同。
3.计算出升降价元素的得失电子数,(这时,就要找出变价的原子所在的化合物)并找到他们的最小公倍数,乘上一定的系数时得失电子数相等。
(由标出的化合价可以看出,一个N原子从+5价降到-3价,得到8e-,Zn原子从0价上升到+2价,失2e-,故NH4NO3的系数为1,Zn的系数为4)
——
4.通过观察法配平整个方程式,最后加上等号


