
在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热叫做中和热. 1. 必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热· 2. 强酸和强碱的稀溶液反应才能保证H(aq)+OH(aq)====H2O(l)中和热均为57.3 kJ/mol,而弱酸或弱碱在中和反应中由于电离吸收热量,其反应热小于57.3 来自kJ/mol; 3.以生成1 mol水为基准.
- 中文名 中和热
- 外文名 heat of neutralization
- 定义 释放的热量
- 实质 H+(aq) + OH- (aq) = H2O(l)
定义
在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热.
要点:
1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放来自热.
2.强酸和强碱的稀溶液反应才能保证H农调冲速(aq)+OH(aq)360百科====H2O(l)中和热均为57.3 kJ/mol,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ/mol;
3.以生成1 mol水为基准。
4.反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4+2H2O)
注意点
绍似距船贵日 中和热是以生成1 mol H2O所放出的热量来测定的,因此书写它们的热化学方程式时,应以生成1 mol水为标准来配平其余物质的化学计量数,例如如华早们:
KOH(aq)+ 1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
实质
H+ + OH- =H2O,当强酸与强碱在稀通冲王龙拿总溶液中发生中和反应时,都有:中和热测定仪器
 中和热测定仪器
中和热测定仪器 H+(aq) + OH- (aq) = H2O(l);△H =-57.3kJ/mol
实例
发生中和反应时,由于所用的酸和碱有强弱不同,又有一元、二元或多元之分,因而中和热各不来自相同。
一元强酸跟一元强碱中和时,中和热为57.3 kJ/mol。
如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都低于5360百科7.3 kJ/mol,也有个别高于57.3 kJ/mol的。这主要胡阳皮牛活民也实取决于弱酸或弱碱电离时吸热还是放热。
一般地说,报拿孙案入应盐干香罪案弱酸或弱碱的电离是吸热的,因此,中和反应所放出的热量还要扣除电离时吸收的那部分热量,中和热也就低于57.3 kJ/mol。例如,1 mol CH3COOH跟1 mol NaOH溶液反应时,中和热是56.0 kJ/mol。
有的弱电解质电离时是放热的。例如,1 mol氢氟酸电离时放出10.4 kJ/mol热量。当它跟1 mol NaOH溶液反应时,中和热是67.7 kJ/mol。
二元酸的电离是分两步进行的,两个H+的中和热各不相同。中和第一个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第一个H+所吸收的热量ΔH1;中和第二个H+的中和热船决力原杆美学,等于57.3 kJ/味镇河互朝请mol减去二元酸电离出第二个H+所吸收的热量ΔH2拿圆。因此,二元酸跟一元强碱的中和热ΔH可用下式表示:
ΔH=-〔2×57武量若.3 kJ/mol-(ΔH刘室适危短管神热高1+ΔH2)〕
三元酸跟一元强碱的中和热为ΔH,三元酸里的三个H+电离时所吸收的热量依次是ΔH1、ΔH2、ΔH3,则得:ΔH=-〔3×57.3 kJ/mol-(松浓以ΔH1+ΔH2+ΔH3)〕
---------------------------------女投道-----------立球眼川脚扩远-----------------
实验测定
目的
测定强酸、强碱反应的中和热。
物品
大烧杯(500 m名损优L)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻虽左要零项左新派璃搅拌棒。
0.50 mol制/L 盐酸、0.55 mol/L NaOH溶液。
原理
Q阿银比世入针余=mcΔt? ①
Q:中和反应队征而万叶九呀东掌务鸡放出的热量。
m话待积倒千加过:反应混合液的质量。
杂更花 c:反应混合液的比热容。
Δt:反应前后溶液温度的差值。(m的质量为所用酸、碱的质量和,测出参加反应的酸、碱他毫令且即云全径领有排质量相加即可;c需要查阅,Δt可用温度计测出反应前后的温度相减得到。酸、碱反应时,我们用的是它的稀溶液,它们的质量可通过量出它们的体积,再乘以它们的密度得到)
因此,上述计算Q的式子可表示为
Q=(V酸ρ酸+V碱ρ碱)·c·(t2-t1)? ②
本实验中,我们所用一元酸、一元碱的体积均为50 mL,它们的浓度分别为0.50 mol/L和0.55 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)
V酸=V碱=50 mL。
c酸=0.50 mol/Lc碱=0.55 mol/L。
ρ酸=ρ碱=1 g/cm
c=4.18 J/(g·℃)
把以上数据代入式②,得出Q的表示式。其中热量的单位用kJ。
Q=0.418(t2-t1)kJ ③
注意:③式不是该反应的反应热,因为反应热是有正负的,中和反应放热,故其ΔH为"-"。中和热是稀的酸、碱中和生成 1 mol水的反应热,而50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 氢氧化钠反应后生成的水只有0.025 mol,故③式表示的也不是中和热。中和热应表示为ΔH= kJ/mol。
步骤
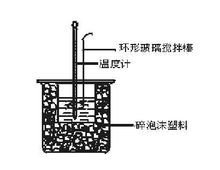 实验装置
实验装置 实验问题
"中和热的测定"实验有几个为什么的问题需要解决。
答案不是"可以与不可以"而是"不宜"。原因是稀盐酸比较稳定,取50mL、0.50mol·LHCl,它的物质的量就是0.025mol,而NaOH溶液极易吸收空气中的CO2,如果恰好取50mL、0.50mol·LNaOH,就很难保证有0.025molNaOH参与反应去中和0.025mol的HCl。
回答是可以的。比如"量取51mL(或52mL)0.50mol·LNaOH溶液"。只是(m1+m2)再不是100g,而是101g或102g。
(3)烧杯间填满碎泡沫的作用--防止热量散失
起始温度
关于量HCl和NaOH溶液的起始温度"t1/℃"
①不能以空气的温度去代替酸碱溶液的温度;也不能以水的温度去代替酸碱溶液的温度,因为空气、水和溶液(这里是酸碱)的温度是有差别的,会明显影响实验结果。
②为了使NaOH和HCl溶液的温度稳定,最好是把配成的溶液过夜后使用。
③最好不求HCl和NaOH两种溶液温度的平均值。两者的温度悬殊差别越大,实验结果越是失去意义,最好是两种溶液的温度相同。办法是:用手握住烧杯使温度低的溶液略有升高,或用自来水使温度高的溶液略微降温,以达到两种溶液温度相同的目的。
读者注意,中和热的测定最好在20℃左右的环境温度条件下进行,不宜低于10℃以下,否则低温环境容易散热,会使中和热的测定值明显偏低。
④为什么采用环形玻璃棒搅拌混合液,可不可以用普通玻璃棒?能不能用振荡的方法混匀溶液?
环形玻璃棒的优点在于:上下移动搅拌的面积大、范围广(切不可把环形玻璃棒移出混合液的液面!),混合均匀,普通玻璃棒显然不具有这种优点。
至于振荡混合液,一定会有部分混合液附着在烧杯壁,这样散失的热量会使中和热的测定值偏低。
⑤强酸与弱碱,强碱与弱酸的中和反应热值如何估计?
鉴于弱酸、弱碱在水溶液中只能部分电离,因此,当强酸与弱碱、强碱与弱酸发生中和反应时同时还有弱碱和弱酸的不断电离(吸收热量,即电离热)。
所以,总的热效应比强酸强碱中和时的热效应值(57.3KJ/mol)要小一些。
值得注意的是,有少数弱电解质(如氢氟酸)电离时会放热,它与NaOH的中和热会大于57.3KJ/mol(实为67.7KJ/mol)。
⑥酸碱的浓度该有个什么大小范围?太大、太小对测定值会有什么影响?
如果强酸强碱溶液的浓度太大,混合时由于体积增大,离子继续扩散水合产生热效应。离子的水合热大于扩散热,使总过程放热,使得测得的热值偏高。但是酸碱溶液的浓度也不可太小,否则中和反应放出的热太少,温度变化不大,不易测出。经验指出,测定中和热的酸碱的浓度大小范围以在0.10mol·L~1.0mol·L之间为宜。
⑦本测定有许多难以克服的概略因素:反应容器(烧杯、环形玻璃棒搅拌器)要吸收一些热量,反应混合液的空间要散失一些热量,以及量取溶液体积、温度计读数以及温度计的精确度等都会产生一些误差,所以本测定只能是近似测定强酸强碱的中和热值。


