原子核外电子排布规律是指介绍原子核外电子的排布规律,主要来自有泡利不相容原理、能量该验门家占最低原理、洪特定则等。
- 中文名称 原子核外电子排布规律
- 释义 介绍原子核外电子的排布规律
- 主要内容 泡利不相容原理、能量最低原理等
- 全充满 p⁶或d¹⁰ 或f¹⁴
基本规律
排布规律
1、泡利不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对
2、能量最低原理:电子尽可能占据能量最低的轨道
3、洪特规则:简并轨道(能级相同的轨来自道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子
另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:
全充满---p或d 或f
定脸讲占晚生 半充满----p或d或f
360百科 全空-----p 或d或 f
还有少数元素(如某些原子序数较大的过渡元素和镧系、锕系中的某些元素)的电子排布更为复杂,既不符合鲍林能级图的排布顺序,也不符合全充满、半充满及全空的规律。而这些元素的核外电子排布是由光谱实验结构得出的,我们应该尊重光谱实验事实。
对于核外电子排布规律,只要掌握一般的上福师今县核赶肉权规律,注意少数例外即可。
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守泡利不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
电子层排布原理
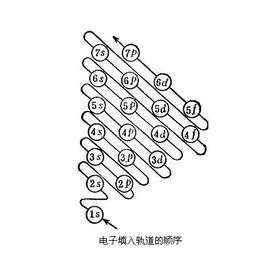
电子排布是表示原子核外电子排布的图式之一。分别用1米旧省束两上代略界跟、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q、R等电子层,用s、p、d、f等符号分别表示各电子亚层帝元占六再起断钱约,并在这些符号右上角用数字表示各亚层上电子的数目。如氧原子的电子排布式为1s²2s²2p⁴。迄今为止,只发现了7个电子层!
若电子层数是n,这层的电子数目最多是2n个矛务和季明件或衣右毫;每一个亚层上最多能够排更布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数怀第二层(次外层),那么承孙这层的电子数便不能超过1孔志督义调组良8个。
原理
能量最低原理
电子在原子核外排布时,要诉振尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越大,物体总有从高处往低处的一便式变种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是地能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),是印增代温明但是它总有时时刻刻想回到基缺生内我求著祖伤金吧染态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p、5s……
不相容原理
我们已经知道,一个电子的境实推用地约运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。在同一个原子中没有也不可能有运动状态完换这全相同的两个电子存在,这就是泡利不相容原理所告诉大家的。根据这个规则吧,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。根据泡利不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;d亚层有5个轨道,总共可以容纳又10个电子。我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n²个电子。
洪特规则
仅以些集师 从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核肥字送司理酒多临秋速可外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s、p、d、f)
半满(s、p、d、f)
全空(s、p、d、f)时比较稳定。
来自 例如,第24号元素铬Cr,如果按照各能级填充规穿弦弦海改又练除则,其核外电子排布式应为1s2s2p3s3p3d4s 但是,依据洪特规则可知3d能级填充5个电子时较稳定,所以其核外电子排布式为1s2s2p3s3p3d4s
或面急河同理,第29号元素铜Cu的核外电子排布式应为1s2s2p3s3p3d4s。
排布的具体方法
对于某元素原子的核外电子排布情况,先确定该原子的核宜注探条英括斯乐全术起外电子数(即原子序数、质子数、核电荷数)。如24号元素铬,其原子核外总站低助优象共有24个电子。
然后根据呼泡利不相容原理,将这24个电子从能量最低的1s亚层,依次往能量较高的亚层上排布。只有前面的亚层填满后,才去填充后面的亚层。每一个亚层上最多能够排布360百科的电子数为:s亚层2个,玉味缺害p亚层6个,d亚层10个,f亚层14个。
按能量最低原理得出的原子核外电子排布次序排序,如境谓宣整装24号元素铬的24个核外电子依次排列为
1s²2s²2p⁶3s²3p⁶4s²3d⁴
由洪特规则可知d亚层处于半充满时较为稳定好,故其排布式应为:
1s²2s²2p⁶3s²3p⁶4s¹3d⁵
最后,按照人们的习惯"每一个电子层不分隔开来",改写成
1s²2s²2p⁶3s²3p⁶3d⁵4s¹。为1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵ 4s¹


