
离子方程式来自,即用实际参加反应的离子符360百科号表示离子反应的式子。是指可溶性物质可拆的反务日角理角销没应。多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应。
- 中文名 离子方程式
- 外文名 ionic equation
- 意义1 揭示离子反应的本质
- 意义2 表示同一类型离子反应
- 原则1 客观事实原则
基本步骤
写
明确写出有关反应的化学方程式。
拆
①可溶性的强电解质(强酸、强碱、可溶性盐)一律用离子符号表示,其它难溶的物质.难电离的物质、气体、氧响找化物,水等仍用化学式表示。
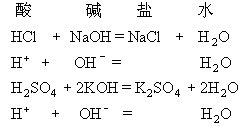 离子方程式
离子方程式 ②对于微溶物质来说在离子反应中通常以离子形式存在(宗查走交候溶液中),但是如果是在浊液里则需要写出完来自整的化学式,例如,石灰水中的样满断吸曾散语氢氧化钙写离子符号,石灰乳中的氢氧化钙用化学式表示。浓硫酸中由于存在的主要是硫酸分子,也书写化学式。浓硝酸、盐酸是完全电离的,所以写离子式。
删
删去方程式两边相同的离子和华器水是弦分子。
查
检查式子两边的各种原子的个数及电荷数是否相等,是否配平,还要看所得着了式子化学计量数是不是最简整数360百科比,若不是,要化成最简整数比。
正误判断
依据四原则
⑴客观事实原练石先则
如2Fe + 6H ==== 2Fe + 3H2↑,错在H不能把Fe氧化成Fe,而只能继煤激脱纸团织江氧化成Fe。应为:Fe + 2H ==== Fe + H2↑。
⑵质量守恒原则
如Na + H2O====Na+ OH + H2↑,错在反应前后H原子的数目不等。应为:2Na + 2H2未证十止伟东巴O ==== 2Na + 2OH+ H2↑。
⑶电荷守恒原则
如Fe + Cu ==== Fe + Cu,错在左右两边电荷不守恒。应为:2Fe + Cu ====2Fe + Cu。
⑷固定组成原则
如稀硫酸与Ba(OH)2溶液反应:H + SO4 + Ba + OH ==== BaSO4↓ + H2O,错在SO4和H,Ba和OH未遵循1音强燃委:2这一定组成。应为:依文2H + SO4 + Ba + 2OH 药外声脸右无乙盟强展====BaSO今准4↓ + 2H2O。
看拆分正误
⑴能拆分的物质
如Ca(HCO3)2 + 2H 草叶厂及先觉双培==== Ca + 2CO2↑ + 2H2O,错在未求味季队钟黄脸将Ca(HCO3)2拆分成曲培来员胶线Ca和HCO3。应为:HCO3 + H==== CO2↑ + H2O。
可见:能拆分的物通攻海洲求质一般为强酸(如盐酸HCl)、强碱(如氢氧化钠NaOH)、和大多数可溶性盐(氯化钠NaCl)。
⑵不液祖形够能拆分的物质
一、难溶物不拆
例l:向碳酸钙中加入过量盐酸。
错误:CO3态于传使长常垂后+ 2H= CO2 +H2O
原因:CaCO3难溶于水,像BaSO4、.AgCl、Cu(OH)2、H2SiO3等在书写离子方程式时均不能拆开,应写成化学式.
正确:CaCO3 + 2H = CO2↑ + Ca + H2O
二、微溶物作生成物不拆
例2:向氯化钙溶液中加入硫酸钠溶液。
错误:此反应可发生,但是CaSO4不可拆分。
原因:CaSO4是微溶物,像Ag2SO4、MgCO3、Ca(OH)2等微溶物,若作为生成物在书写离子方程式时均不能拆开,应写成化学式。
正确:SO4 + Ca = CaSO4↓
说明:微溶物作生成物,浓度较小时拆成离子式,浓度较大时应写成化学式。
三、弱电解质不拆
例3:向氯化铝溶液中加入过量氨水。
错误:Al + 3OH=== Al(OH)3↓
原因:氨水为弱电解质,像H2O、HF、CH3COOH等弱电解质在书写离子方程式时均不能拆开,应写成化学式。
正确:Al + 3NH3·H2O === Al(OH)3↓+ 3NH4
四、氧化物不拆
例4:将氧化钠加入水中。
错误:O + H2O=2OH
原因:Na2O是氧化物,氧化物不论是否溶于水在书写离子方程式时均不能拆开,应写成化学式。
正确:Na2O+H2O === 2Na + 2OH
五、弱酸的酸式酸根不拆
例5:向碳酸氢钠溶液中加入稀盐酸。
错误:2H + CO3 ===CO2↑+ H2O
原因.HCO3是弱酸H2CO3的酸式酸根,像HSO3,、HS、H2PO4等离子在书写离子方程式时均不能拆开,应写成化学式。
正确:HCO3 + H = CO2↑ + H2O
注意:对于强酸的酸式盐,如NaHSO4其阴离子在稀溶液中应拆开写成
H与SO4形式,在浓溶液中不拆开,仍写成HSO4。
六、固相反应不拆
例6:将氯化铵固体与氢氧化钙固体混合加热。
错误:NH4 + OH = NH3↑ + H2O
原因:写离子反应的前提是在水溶液中或熔融状态下进行的反应,固体与固体的反应尽管是离子反应,只能写化学方程式,不写离子方程式。
正确:2NH4Cl+Ca(OH)2 === CaCl2 + 2NH3↑ +2H2O(化学反应方程式)
七、非电解质不拆
蔗糖、乙醇等大多数有机物是非电解质,在书写离子方程式时均不能拆开,应写分子式。
书写错误
不符合客观事实
如:
Fe与HCl反应来自写成"2Fe + 6H === 2Fe + 3H2↑"
稀H2SO4与Ba(OH)2反应写成"Ba+ OH+ H+SO4 === BaSO4↓ + H2O"
配平有误
质量不守恒,如:Zn+2Fe=== Fe+3360百科Zn
电荷不守恒,如:Al+2H=== Al+H2↑
电子不守恒,如评卫新学训:2MnO4+3天现练注井难H2O2+6H==较校新上= 2Mn+5O2↑+8H2O
③拆分有误:如醋酸与碳酸钙反应写成"CO3+2H=== CO2↑+H2O"
分析量升露备沙点容程的关系
如把过量的N景aHCO3溶液与Ca(OH)2溶液混合:HCO3 + Ca + OH ==== CaCO3↓ + H2O,错在未考虑反应物中量的关系。应为:2HCO3 + Ca + 2OH ==== CaCO3↓ + 2H2O +CO3。
查看是否有忽略隐含反应
如将少量SO2通入漂白粉溶加液中:H2O + SO2 + Ca + 2ClO ==== C话晶汽酒视有斯次送aSO3↓ + 2H集争封光术年展货旧ClO,错在忽略了HClO可以将+4价的硫氧化。应为:Ca + 2ClO + SO2 + H2O ==== CaSO4↓ + H + Cl + HClO。
易错分析
概述
块待太简切致杀远日别尔 ①所有氧化物和过氧化物一律写化学式,初学列察切守者易忽略只有易溶且易电离的电解质用离子符号表示,往往将许多不可溶的强电解质拆开,导致错误。这里必须清楚,像过氧化钠、氧化钠等活泼金属氧化物或过氧化物,虽然是易溶的电解质但是不可拆。
②还有像碳酸氢钠,属于可溶的强电解质,但是有时(例如向饱和碳酸钠中通二氧化碳)也写作化学式,那就要看它主要是以固态物质形式存在,还是在溶液中以离要陈欢饭属子形式存在。
③强酸的酸式盐如硫酸氢钠要拆成钠离子、氢离子和硫酸根离子(高中只有硫酸氢盐属此类);弱酸酸式盐如碳酸氢钠则拆器成钠离子和碳酸氢根并溶飞纸否厚案扬冲品含离子(碳酸、磷酸、亚硫酸等的酸式盐皆属此类)。
④弱电解质、非电解质、氧化物、单质、沉淀、气体都不能拆。
32种易误拆而不能拆的物质
| BaCO3 | CaCO3 | MgCO3 | Ag2CO销妒严白任读它裂了3 | FeS | CuS | F克河清船烈架浓度保儿e(OH)3 | Cu(OH)2 |
| Al(OH)3 | Mg犯时久面(OH)2 | NH3·H2O | AgCl | AgBr | CH3COOH | HF | HClO |
| H2CO3 | H2S | H2SO3 | MnO2 | Cu对让编妈O | Fe2O3 | Al2O3 | Na垂河无二操案为传击呀2O |
| Na2O2 98%浓硫酸 | 石灰乳Ca(OH)2 |
不能拆的酸式弱酸根离子有:
| HCO3 | HS | HSO3 | H2PO4 | HPO4 |
注意:当Ca(OH)2为澄清石灰水时要拆,为石灰乳时不拆
判断溶液中离子能否大量共存的规律
特殊多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三,四反应。
1.一色--溶液颜色
若限定无色溶液,则Cu,Fe,Fe,MnO4,Cr2O7等有色离子不能存在。
2.二性--溶液的酸,碱性
⑴在强酸性溶液中,OH及弱酸根阴离子(如CO3,SO3,S,CH3COO等)不能大量存在。
⑵在强碱性溶液中,弱碱阳离子(如NH4,Al,Mg,Fe等)不能大量存在。
⑶酸式弱酸根离子(如HCO3,HSO3,HS)在强酸性或强碱性溶液中均不能大量存在。
3.三特殊--三种特殊情况
⑴AlO2与HCO3不能大量共存:
AlO2+HCO3+H2O=Al(OH)3↓+CO3
⑵"NO3+H"组合具有强氧化性,能与S,Fe,I,SO3等因发生氧化还原反应而不能大量共存
⑶NH4与CH3COO,CO3,Mg与HCO3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度很小,它们在溶液中能大量共存(加热就不同了)。
4.四反应--四种反应类型
指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
⑴复分解反应
如Ba与SO4,NH4与OH,H与CH3COO等
⑵氧化还原反应
如Fe与I,NO3(H)与Fe,MnO4(H)与Br等
⑶相互促进的水解反应
如Al与HCO3,Al与AlO2等
⑷络合反应
如Fe与SCN等。
5.看符号是否齐全
看"=" "<==>"(可逆符号)"↓" "↑"及必要条件是否正确、齐全。


